پیراسته فر
علمی،تحقیقی و تحلیلیپیراسته فر
علمی،تحقیقی و تحلیلیکریسپر"نوکلئاز"تلنز
درادامه ....«سلولT» چیست؟ ...«سلول بنیادی خون ساز»کدامند؟،«نوکلئوتیدها» چیست؟
۳ نوکلئاز(nucleases) برای ویرایش ژنها : ZFN ها ، TALEN ها و CRISPR-Cas9
۱- ZFN«نوکلئاز انگشت روی» (Zinc Finger Nuclease)
۲- TALENs«نوکلئازهای فعال کننده شبیه رونویسی» (transcription activator-like effector nucleases)
۳- CRISPER «خوشه ای به طور منظم بین فواصل کوتاه تکرار پالیندرومیک»(Clustered Regularly Interspaced Short Palindromic Repeat )
این مورد ، دوران ویرایش ژنومی را متحول کرده است.
- اولین اندونوکلئازها نوکلئازهای انگشت روی (ZFNs) بودند. اینها بر اساس پروتئین های انگشت روی ، خانواده ای از عوامل رونویسی که به طور طبیعی وجود دارند ، بر روی اندونوکلئاز (Endonucleases)FokI1 ترکیب شده اند.
دامنه های انگشت روی می توانند توالی DNA تری نوکلئوتیدی را تشخیص دهند. بنابراین ، مجموعه ای از دامنه های انگشت روی مرتبط می توانند توالی های DNA طولانی تر را تشخیص داده و ویژگی مورد نظر را در مورد هدف ارائه دهند. با این حال ، نقوش انگشت روی روی یک آرایه بر ویژگی انگشتان روی همسایه تأثیر می گذارد و باعث می شود طراحی و انتخاب آرایه های انگشت روی اصلاح شده چالش برانگیزتر و وقت گیرتر باشد. پیش بینی ویژگی چیدمان نهایی دشوار است. اندونوکلئاز FokI به عنوان یک دیمر عمل می کند ، به این معنی که شکاف DNA دو رشته ای تنها در محل های اتصال دو ZFN به رشته های DNA مخالف رخ می دهد (شکل 1A).
این سیستم بر اساس دو ZFN طراحی شده است تا توالی های نوکلئوتیدی نزدیک یکدیگر را در محل مورد نظر تشخیص دهد و نیاز به تشخیص و اتصال همزمان هر دو ZFN دارد که طبیعتاً اثرات خارج از هدف را محدود می کند.
- نوکلئازهای فعال کننده شبیه رونویسی (TALENs) پروتئین های تلفیقی از پروتئین TALE باکتریایی و اندونوکلئاز FokI2 هستند.
مشابه ZFN ها ، ویژگی هدف از ارتباط پروتئین-DNA ناشی می شود. در مورد TALEN ها ، یک طرح TALE تنها یک نوکلئوتید را تشخیص می دهد و آرایه ای از TALEs می توانند با دنباله طولانی تری مرتبط شوند (شکل 1B).
فعالیت هر دامنه TALE فقط به یک نوکلئوتید محدود می شود و بر ویژگی اتصال TALEs همسایه تأثیر نمی گذارد و مهندسی TALEN ها را بسیار ساده تر از ZFNs می کند. به طور مشابه با ZFN ها ، نقوش TALE با اندونوکلئاز FokI مرتبط هستند ، که برای ایجاد شکاف نیاز به دیمیراسیون(dimerization) دارد. این بدان معنی است که اتصال دو TALEN مختلف در رشته های مخالف در مجاورت DNA مورد نیاز است.
* سیستم CRISPR-Cas9 (تکرارهای کوتاه کوتاه پالیندرومیک به صورت مرتب و خوشه ای) بر اساس سیستم ایمنی باکتری است.
این شامل نوکلئاز Cas9 و دو نوع RNA است: CRRNA فعال کننده فعال (tracrRNA) و یک RNA راهنمای واحد (sgRNA) که توالی هدف را با زوج استاندارد پایه واتسون-کریک تشخیص می دهد. پس از آن باید یک موتیف DNA به نام موتیف مجاور protospacer (PAM) دنبال شود.
هر پروتئین Cas9 دارای یک دنباله PAM خاص است ،
به عنوان مثال ، برای Cas9 استاندارد 5'-NGG-3 'است. برش DNA توسط نوکلاز Cas9 انجام می شود و در صورت استفاده از انواع آنزیمی وحشی به یک رشته دو رشته ای منجر می شود یا هنگام استفاده از انواع جهش یافته Cas9 به نام نیکاس منجر به شکست یک رشته می شود (شکل 1C).
تشخیص محل DNA در سیستم CRISPR-Cas9 توسط فعل و انفعالات RNA-DNA کنترل می شود. این مزایای زیادی نسبت به ZFN ها و TALEN ها دارد ، از جمله طراحی آسان برای اهداف ژنومی ، پیش بینی آسان در مورد سایتهای خارج از هدف و امکان تغییر چندین سایت ژنومی به طور همزمان
شکل 1. ویرایش نوکلئازها. A. ZFN - دو ZFN مجزا تشخیص داده و به مکانهای خاصی در رشته های DNA مخالف متصل می شوند. دایمر FokI مونتاژ شده به طور خاص DNA هدف را می شکند. B. TALEN ها - دو TALEN جدا از هم تشخیص می دهند و به مکانهای خاصی در رشته های DNA مخالف متصل می شوند.
دایمر FokI مونتاژ شده به طور خاص DNA هدف را می شکند. ج- در سیستم CRISPR-Cas9 ، محل DNA با تکمیل پایه بین DNA ژنومی و sgRNA ، مرتبط با tracrRNA ، تشخیص داده شده و در نوکلئاز Cas9 بارگذاری می شود ، که برش DNA را انجام می دهد.
ویژگی هدف ، مکانیسم عمل و طراحی آزمایشی برای ویرایشهای رایج مورد استفاده در نوکلئازها.جدول۱
کاهش اثرات خارج از هدف
طراحی ویرایش نوکلئازها به نحوی که اثرات خارج از هدف را کاهش دهد ، نه تنها برای رویکرد علوم پایه بلکه برای استفاده بالینی و صنعتی احتمالی آنها یک مسئله مهم بود.
تحویل ZFN ها و TALEN ها ، چه در شرایط in vivo و چه in vitro ، می تواند به دلیل اتصال در مکان های خارج از هدف و ایجاد شکاف DNA ناخواسته منجر به مسمومیت یا کشندگی شود.
جهش در FokI در مورد ZFN ها و TALEN ها برای ترویج فعالیت اندونوکلئاز FokI تنها در طول رویدادهای هترو دیمریزه شدن در مکانهایی که توسط دو نوکلئاز گسسته محدود شده اند معرفی شد.
برش خارج از هدف سیستم های CRISPR-Cas9 عمدتاً از تشخیص سایتهای ژنومی کاملاً یا تا حدی مکمل توسط sgRNAs8 ناشی می شود. روشهای مختلفی برای محدود کردن برش خارج از هدف پیشنهاد شده است ، از جمله محدود کردن مقدار و زمان پروتئین فعال Cas۹ در سلولها با روشهای تحویل انتخابی یا تغییر نیمه وقت Cas9۹.
تعدادی از انواع Cas۹ با ویژگی خارج از هدف توسعه یافته است ، از جمله HF-Cas9 ، eCas۹ و HypaCas910–12. انواع جدید همولوگهای Cas۹ و Cas9 ، مانند CRISPR-Cas12 (Cpf1) و CRISPR-Cas13a (C2c2) ، می توانند PAM های مختلف را تشخیص دهند ، نه تنها به طور قابل ملاحظه ای گزینه های ویرایش ژنوم دقیق را افزایش می دهند ، بلکه به طور بالقوه دارای ویژگی خاص در هدف هستند.
یک جایگزین جالب یک ترکیب Cas۹ با Noklease FokI است که مزایای ZFNs/TALENs و سیستم CRISPR-Cas9 را ترکیب می کند.
کیمرهای Cas۹ به عنوان ابزارهای تحقیقاتی جدید - نه تنها برای برش DNA
کیمرهای مختلف Cas۹ ، از جمله مطالعات مربوط به کاهش عملکرد و افزایش عملکرد ، به تازگی توسعه یافته اند.
وجود Cas9 امکان هدف گیری ژنومی را فراهم می کند ، در حالی که پروتئین های اضافی دیگر می توانند فعالیت Cas9 را تعدیل کنند.
در "تداخل CRISPR" (CRISPRi) ، همجوشی پروتئین Cas۹ با یک حوزه تأثیرگذار سرکوبگر KRAB امکان تنظیم بیان ژن را با سرکوب رونویسی فراهم می کند. این روش مزیتی نسبت به تکنیک های استاندارد تداخل RNA (RNAi) ایجاد می کند و امکان بررسی عملکرد ژن های کد کننده غیر پروتئینی را فراهم می کند. علاوه بر این ، روش مخالف (فعالسازی CRISPR ، CRISPRa) امکان پذیر است. ادغام Cas9 با دامنه های فعال سازی رونویسی (به عنوان مثال ، VP64) منجر به افزایش بیان مکان های ژنومی مورد نظر می شود. فعال سازی اضافی رونویسی را می توان با واسطه فعال سازی هم افزایی (SAM) به دست آورد ، جایی که تلفیق Cas۹ شامل چندین حوزه فعال سازی برای به حداکثر رساندن کارایی فعال سازی است.
برخی از کیمرهای Cas۹ فعالیت نوکلئاز ندارند. به عنوان مثال ، ترکیبات Cas9 با آنزیمهای اصلاح کننده کروماتین در مطالعات اپی ژنوم برای تجسم مکانهای اتصال پروتئین به DNA ، برای بررسی ساختار کروماتین یا برای تحقیقات اصلاح هیستونها پس از ترجمه استفاده می شود
CRISPR-Cas9 و نوآوری های ویرایش ژن خط سلولی
از CRISPR-Cas9 می توان برای معکوس کردن جهش های ژنتیکی مضر در ژنوم انسان استفاده کرد. این رویکرد به پروتئین Cas9 ، tracrRNA و sgRNA مخصوص سایت همراه با قالب DNA ترمیمی حاوی توالی نوع وحشی نیاز دارد. Cas9 یک شکست DNA مخصوص سایت ایجاد می کند که متعاقباً توسط ماشین های تعمیر DNA میزبان ترمیم می شود و آلل های نوع وحشی را بازیابی می کند (شکل 2A).
CRISPR-Cas9 همچنین می تواند به عنوان یک ابزار قابل اعتماد در مهندسی خط سلولی عمل کند. این رویکرد مستلزم تحویل پروتئین Cas9 ، tracrRNA و sgRNA مخصوص سایت است. Cas۹ یک شکست DNA مخصوص سایت ایجاد می کند که توسط دستگاه تعمیر DNA میزبان ترمیم می شود. در غیاب الگوی تعمیر ، می تواند منجر به کوتاه شدن جهش های پوچ شود. یک روش هدفمندتر با معرفی الگوهای تعمیر حاوی جهش مورد نظر در دسترس است (شکل 2B)
راه های آینده
ویرایش نوکلئازها مهندسی ژنوم را متحول کرده و امکان ویرایش آسان ژنوم پستانداران را فراهم کرده است. آنها معمولاً نه تنها در تحقیقات اساسی بلکه در مطالعات پیش بالینی و بالینی نیز به عنوان مکانیسم بالقوه برای معکوس کردن جهش های ایجاد کننده بیماری های مبتنی بر DNA در بیماریهای ژنتیکی ارثی استفاده می شوند. نوآوری های غیرتجاری و تجاری اجازه توسعه مداوم فناوری هایی را داده اند که تنها ۲۰ سال پیش آغاز شده اند و در آینده حتی بیشتر در پیشرفت علم و زیست پزشکی استفاده خواهند شد.
توضیح مدیریت سایت-پیراسته فر:منبع این مقاله :یک سایت انگلیسی زبان درباره عملکردکریسپر/۱۰ مهر ۱۳۹۷
ومقاله بعدی ازمنابع دیگر
کاربرد بالینی درمانهای سلولی ویرایش شده با ژن ex vivo اولین بار با ویرایش «نوکلئاز انگشت روی»(zinc finger nuclease) روی سلولهای T+ CD4+ اتولوگ آغاز شد. ویرایش با هدف ایجاد اختلال در بیان ژن CCR5 گیرنده ویروس نقص ایمنی انسانی ، با هدف ایجاد سلولهای مقاوم در برابر ورود ویروس ، قبل از تزریق مجدد به بیمار انجام شد. از آن زمان به بعد با ورود فن آوری های ویرایش جدید نوکلئازهای فعال کننده رونویسی (TALENs) و تکرارهای کوتاه کوتاه(palindromic) پالیندرومیک (CRISPR) و مزایای بالقوه ویرایش ژن در عرصه های ایمونوآنکولوژی و اختلالات خونی به سرعت تشخیص داده شد. از آنجا که گستردگی درمان های سلولی موجود از نظر بالینی همچنان در حال افزایش است ، علاقه روزافزون به رویکردهای آلوژنیک و خارج از قفسه و استراتژی های ویرایش چندگانه به طور فزاینده ای مورد استفاده قرار می گیرد. ما در اینجا آخرین آزمایشات بالینی با استفاده از این فناوری های ویرایش را مرور می کنیم و برنامه های کاربردی را در نظر می گیریم.
زمینه
سلول درمانی به عنوان تجویز سلول های زنده به بیمار با هدف ترمیم یا جایگزینی سلول ها یا بافت های آسیب دیده تعریف می شود. این بیماری به جمعیت سلولی از پیش تعیین شده ای وابسته است که می تواند از یک بیمار (اتولوگ) یا از یک اهدا کننده متفاوت (آلوژنیک) باشد. نوع سلول درمانی با آزمایشات بالینی که در حال حاضر تحت سلطه سلول های خون ساز ، سلول های پیام رسان «مزانشیمی » و «لنفوسیت ها »قرار دارد ، بسیار متفاوت است.
سلول های اپی تلیال تیموس(TEC)
اما با فرکانس پایین تر ، «سلولهای دندریتیک» ، «سلولهای کبدی» ، سلولهای «اپیتلیال» و انواع دیگر در حال بررسی است . از نظر بیماری ،« انکولوژی»(تشخیص سرطان) مسئول بیش از نیمی از آزمایشات سلول درمانی است . نکته قابل توجه این است که عرصه نوظهور درمان های سلولی با تأییدیه های متعددی در سال های اخیر تقویت شده است . برخلاف سایر درمان ها ، سلول درمانی ها محصولات سلولی زنده هستند و با استفاده از مهندسی ژنتیک می توان آنها را برای دستیابی به اثربخشی بهتر و یا متناسب با تک تک بیماران افزایش داد. نکته مهم این است که آنها برای نشان دادن ایمنی و سازگاری به ویژگی های گسترده ای نیاز دارند. در این زمینه قابل توجه است که توزیع in vivo ، بقا و اثر بخشی آنها در هدف ، بلکه بافتهای خارج از هدف پارامترهای حیاتی هستند. به عنوان مثال ، فعالیتهای خارج از هدف منجر به عوارض جانبی شدید شد ، در حالی که سایر عوارض جانبی و مرگ و میر در طول آزمایشات بالینی نیز گزارش شده است. این امر همراه با این واقعیت که بیشتر آزمایشات بالینی سلول درمانی هنوز بدون اطلاع از توزیع in vivo و سرنوشت سلول های درمانی تجویز شده انجام می شود ، منجر به پیشنهاداتی برای پیگیری معمول ردیابی سلول های درون بدن (با تصویربرداری) شد و ژنهای خودکشی .
در اعضا «لنفاوی ثانویه»، «لنفوسیت های B» با سلول های دندریتی فولیکولی پراکنده واکنش نشان می دهند.این سلول ها دارای زوائد فیلامانی بلندی هستند و برخلاف دیگر سلول های دندریتی، دارای منشا مزانشیمی می باشند و عمکرد ان ها وابسته به مولکول های MHC کلاس 2 نیست. سطح این سلول ها توسط کمپلکس آنتی ژن_ آنتی بادی پوشیده شده که به پروتئین های کمپلمان و نواحی Fc ایمونوگلوبولین وصل شده و د رنهایت به سلول های B متصل می شوند و آن ها را فعال می نمایند. نتیجه این اعمال ایجاد گره های لنفاوی کوچک اولیه است. با کمک و همراهی لنفوسیت های T در مجاورت این ساختمان ها ، سلول های B به تدریج گروه های بزرگتری به نام «گره های لنفاوی ثانویه» را ایجاد می نمایند.
«پروتوانکوژنها »،ژنهایی هستند که برخی از آنها فاکتورهای رشد سلول، برخی دیگر، «رسپتورهای» فاکتورهای رشد، دستهای از آنها اجزاء سیستم انتقال پیام داخل سیتوپلاسم، عدهای فاکتورهای رونویسی و برخی از آنها فاکتورهای کنترل کننده سیکل سلولی را کد میکنند.
برخی از ویروسها دارای ژنهایی مشابه «انکوژنهای سلولی» میباشند که در صورتیکه این ویروسها وارد سلولهای عادی شوندموجب سرطانی می شوند،به عبارتی،«انکوپروتئینها» باعث سرطانی شدن سلولها میشوند.
« انکوپروتئین»،محصول پروتوانکوژنها هستند.
انکوژنها(ژنهای تومورزا) ژنهای تغییر یافتهای هستند که در حالت عادی پروتئینهایی را، که در کنترل رشد و تکثیر سلولها نقش دارند، بیان میکنند. این ژنها در حالت عادی «پروتوانکوژن» نامیده میشوند.
ولی در صورت بروز جهش در پروتوانکوژنها، آنها به انکوژنها تبدیل میشوند. انکوژنها باعث بروز سرطان میشوند.
جهشهایی که پروتوانکوژنها را به انکوژنها تبدیل میکنند، اغلب باعث بیان بیش از حد فاکتورهای کنترلی، افزایش تعداد ژنهای کد کننده آنها و یا تغییر فاکتورهای کنترلی بصورتیکه فعالیت فاکتورها، افزایش یابد و یا نیمه عمر آنها در سلول زیاد شود، میگردد.
ابتدا انکوژنها در ویروسها کشف شدند که انکوژنهای ویروسی نامیده میشوند.
به واسطه جهش در پروموتر پروتوانکوژنها آنها به انکوژنها فعال تبدیل شده و بیان آنها زیاد شده، تکثیر سلولها افزایش یافته و تومور ایجاد میشود.
از آنجا که اثربخشی و تطبیق بهتر با بیماران به طور فزاینده ای از طریق مهندسی ژنتیک به دست می آید ، جنبه های مربوط به ایمنی اخیر می تواند در این مرحله به سلولهای درمانی تبدیل شود. به طور سنتی ، مهندسی ژنتیک با استفاده از بردارهای ویروسی (به عنوان مثال γ-retroviruses ، lentiviruses) ، که ترانس ژن ها را کم و بیش به طور تصادفی در ژنوم ادغام می کند ، به دست آمده است .پ این رویکرد اغلب به عنوان "ژن درمانی" نیز طبقه بندی می شود و در درمان های سلولی در علل مختلف استفاده می شود ، به عنوان مثال ، از ایمونوتراپی سرطان تا تنظیم تحمل ایمنی در بیماریهای خود ایمنی.
شکل خاصی از« مهندسی ژنتیک ویرایش ژن »است که روش بسیار بیشتری را برای ادغام بار ژنتیکی مطلوب در مکانی مشخص در ژنوم سلولهای هدف ارائه می دهد .
از آنجا که وسعت درمانهای سلولی موجود از نظر بالینی همچنان در حال افزایش است و روشهای ویرایش ژن فرصتهای بالقوه ای را برای تغییر بازی فراهم می کند ، ما در اینجا آخرین آزمایشات بالینی را با استفاده از این فناوری جدید مرور می کنیم.
راه باریک و پیچ در پی درمان سلول های مهندسی ژنتیک
در حالی که استراتژی های مهندسی ژنتیک به طور کلی درمان های سلولی را به نفع بیماران افزایش داده است ، این سفر هموار نبوده است. اولین گزارش مهندسی سلول درمانی موفق در بیماران مبتلا به نقص سیستم ایمنی شدید (SCID-X1) مرتبط با X و شامل جمع آوری CD34+ hSC های بیمار ، انتقال آنها به صورت in vivo با یک رتروویروس γC Moloney با کمبود تکرار حاوی ژن زیر واحد مشترک گیرنده cC ، بود. یک ژن مرتبط با کروموزوم X که در بیماران SCID-X1 غیر فعال می شود و آنها را عاری از سلولهای T بالغ و قاتل طبیعی (NK) می کند .
هدف از این روش بازگرداندن ظرفیت بیمار برای تشکیل سلولهای T و NK بالغ بود. hSC های مهندسی شده مجدداً به بیماران
بردارهای ویروسی هم بیان ژن قوی و هم کارآیی بالای مهندسی و همچنین علت را امکان پذیر کرده بودند
راه باریک و پیچ در پی درمان سلول های مهندسی ژنتیک
در حالی که استراتژی های مهندسی ژنتیک به طور کلی درمان های سلولی را به نفع بیماران افزایش داده است ، این سفر هموار نبوده است. اولین گزارش مهندسی سلول درمانی موفق در بیماران مبتلا به نقص سیستم ایمنی شدید (SCID-X1) مرتبط با X و شامل جمع آوری CD34+ hSC های بیمار ، انتقال آنها به صورت in vivo با یک رتروویروس γC Moloney با کمبود تکرار حاوی ژن زیر واحد مشترک گیرنده cC ، بود. یک ژن مرتبط با کروموزوم X که در بیماران SCID-X1 غیر فعال می شود و آنها را عاری از سلولهای T بالغ و قاتل طبیعی (NK) می کند .
هدف از این روش بازگرداندن ظرفیت بیمار برای تشکیل سلولهای T و NK بالغ بود. hSC های مهندسی شده مجدداً به بیماران تزریق شد و طی ۱۰ ماه نتایج مثبت مشاهده شد ، در حالی که محفظه های T و NK بیمار توسط سلولهای بیان کننده ژن γC پر شده بود. متأسفانه ، نزدیک به ۳ سال پس از تزریق ، دو بیمار در نتیجه گسترش کلونی سلولهای T مهندسی شده دچار سرطان خون شدند. هر دو بیمار تزریق «پروویرال»(ماسترولون) داشتند که منجر به فعال شدن «پروتوآنکوژن» LMO2 و تکثیر تصاعدی این سلول ها شد.(انکوژن شکل جهش یافته)
بردارهای ویروسی هم بیان ژن قوی و هم کارآیی بالای مهندسی را امکان پذیر کرده بودند ، اما باعث بیماری پایین دست نیز شده و بدین ترتیب روشن شد که درک بهتری از خطرات بلندمدت مهندسی ژنتیک مورد نیاز است. در سالهای پس از این مطالعه ، تعداد زیادی بردار جدید برای کاهش پتانسیل ایجاد جهش زایی درونی و افزایش ایمنی طراحی شد ، اما برخی در این زمینه در حال حاضر به دنبال استراتژی دقیق تری برای معرفی تراریخته در مکان های مشخص شده در ژنوم بودند.
توسعه روشهای مهندسی ژنتیک ویژه سایت
پس از کشف اینکه شکستگی های دو رشته ای DNA (DSB) می تواند باعث ترمیم شود ، دانشمندان به دنبال بهره برداری از فرایند ترمیم به منظور دستکاری سلول ها با دقت یک جفت پایه بودند. نوکلئازهای متمایز با ظرفیت تشخیص توالی های DNA مورد علاقه (محل های تشخیص) در ژن های درون زای پستانداران مهندسی شد ، که همچنین می تواند DNA را در این مکان ها برش دهد. محققان اصول« اندونوکلئازهای» خانگی را که برای اولین بار در مخمر جوانه زده کشف شد ، دنبال می کردند و پایه های آنچه به عنوان «ویرایش ژن» معروف شد را پایه گذاری کردند. این رویکردهای ویرایش هدفمند در حال حاضر به طور گسترده ای در تحقیقات بالینی و بالینی مورد استفاده قرار می گیرد.
«نوکلئازهای انگشت روی» (ZFNs) اولین نوکلئازهای طراح بودند که از خانواده فاکتورهای رونویسی طبیعی شناخته شده به نام پروتئین انگشت روی تولید شدند و با اندونوکلئاز FokI ترکیب شده اند. پروتئین های انگشت روی به عنوان حوزه های متصل به DNA عمل می کنند که دنباله های DNA «تری نوکلئوتیدی »را تشخیص می دهد ، و پروتئین هایی که به صورت سری به هم پیوند خورده اند امکان شناسایی توالی های DNA طولانی تر را فراهم می کنند و در نتیجه ویژگی تشخیص توالی را ایجاد می کنند. FokI ذوب شده به عنوان یک دیمر عمل می کند.
بنابراین ZFN ها برای تشخیص توالی »نوکلئوتیدها» در مجاورت یکدیگر جفت می شوند (شکل 1a). این اطمینان می دهد که DSB ها تنها زمانی تولید می شوند که دو ZFN همزمان به رشته های متضاد DNA متصل شوند ، به این ترتیب ویژگی تشخیص توالی با طول دامنه های متصل شده به DNA تعیین می شود. این امر اثرات خارج از هدف را محدود می کند ، اما با جنبه منفی آن آرایه های نقوش انگشت روی روی ویژگی انگشت روی روی همسایه تأثیر می گذارد و طراحی و انتخاب آنها را چالش برانگیز می کند.
مطالعات اولیه بر تحویل کاست بیان ZFN به سلولها از طریق قطعات DNA مشتق شده از ناقلهای ویروسی متکی بود.
مطالعات بعدی با استفاده از انتقال mRNA از طریق «الکتروپوراسیون» برای ورود به سلولهای هدف پیشرفت کرد. این رویکرد سطوح گذرا اما بالایی از کاست بیان را در داخل سلول ها ارائه می دهد و خطر کمتری برای درج/جهش زایی در مکان های خارج از هدف در نتیجه نیمه عمر کوتاه تر mRNA در مقایسه با DNA ارائه می دهد.
این مشخصات ایمنی بهبودیافته با مزایای انتقال بسیار کارآمد (با سطوح> 90 reported گزارش شده) و ماندگاری عالی سلول
«فناوریهای ویرایش ژن »مورد استفاده در سلول درمانی سه ساختار اساسی و ویژگی های اصلی هر پلت فرم ویرایش که به طور بالینی در درمان های سلولی مورد استفاده قرار می گیرد نشان داده شده است که نحوه تعامل ویرایشگر با DNA را به منظور شروع شکست دو رشته نشان می دهد.
«نوکلئازهای انگشت روی» (ZFNs) شامل پروتئین های انگشت روی هستند که مستقیماً به اندونوکلئازهایی مانند FokI متصل شده اند. پروتئین های انگشت روی به عنوان حوزه های متصل به DNA عمل می کنند که دنباله های DNA تری نوکلئوتیدی را تشخیص می دهد ، و پروتئین هایی که به صورت سری به هم پیوند خورده اند امکان شناسایی توالی های DNA طولانی تر را فراهم می کنند و در نتیجه ویژگی تشخیص توالی را ایجاد می کنند.
FokI ذوب شده به عنوان یک دیمر عمل می کند ، بنابراین ZFN ها برای تشخیص توالی های نوکلئوتیدی در مجاورت یکدیگر مهندسی می شوند و اطمینان حاصل می شود که DSB ها تنها زمانی تولید می شوند که دو ZFN همزمان به رشته های مخالف DNA متصل شوند. b نوکلئازهای فعال کننده شبیه رونویسی (TALENs) شامل پروتئین های TALE باکتریایی است که با اندونوکلئازها مانند FokI ترکیب شده اند. مانند ZFN ها ، برای شروع شکستن DNA نیاز به اتصال جفتی دارد.
در اینجا ویژگی هدف گیری DNA از آرایه های TALE ماژولار ناشی می شود که برای تشخیص توالی های جانبی DNA به هم متصل شده اند ، اما هر TALE فقط یک نوکلئوتید واحد را تشخیص می دهد.
پلتفرم CRISPR/Cas9 مانند ZFN ها و TALEN ها به اتصال پروتئین به DNA متکی نیست ، اما ویژگی هدف گیری DNA خود را از زوج پایه Watson-Crick RNA-DNA RNA راهنما (gRNA) با محل تشخیص می گیرد.
در ابتدا Cas9 به موتیف مجاور protospacer (PAM) متصل می شود ، این یک توالی DNA 2-6 جفت باز است که مخصوص هر پروتئین Cas است.
بدون دنباله صحیح PAM ، Cas DNA را متصل یا قطع نمی کند. پس از شناسایی صحیح PAM ، Cas باقی مانده DNA را ذوب می کند تا مکمل توالی «gRNA »را آزمایش کند.
اتصال PAM به پروتئین Cas اجازه می دهد تا به سرعت اهداف بالقوه را غربال کرده و در حین جستجوی توالی های کاملاً مکمل از ذوب تعداد زیادی توالی غیر هدف جلوگیری کند.
«نوکلئوتیدها» چیست؟
نوکلئوتید، یک مولکول آلی است که واحد سازنده اسیدهای نوکلئیک DNA و RNA به شمار میرود. به جرات میتوان گفت نوکلئوتیدها درون زنجیره DNA، ماده ژنتیکی همه موجودات زنده شناخته شده را تشکیل میدهند و آن را به نسلهای بعدی منتقل میکنند. اما علاوه بر ذخیره و انتقال اطلاعات ژنتیکی، نوکلئوتیدها نقشهای دیگری را نیز در سلول بر عهده دارند. به عنوان مثال، میتوان به عملکرد آنها در قالب مولکولهای حامل انرژی اشاره کرد. علاوه بر این، نوکلئوتیدها نقشهایی را در فرایندهای مربوط به سیگنالینگ (انتقال پیام) سلولی، متابولیسم و واکنشهای آنزیمی بر عهده دارند.
نمای شماتیک نوکلئوتید ATP.
چهار نوع نوکلئوتید موجود در DNA
چهار باز نیتروژنی آدنین، سیتوزین، گوانین و تیمین در ساختمان DNA به کار میروند. در مولکول RNA نوکلئوتید حاوی یوراسیل، جایگزین تیمین میشود.
ساختار نوکلئوتید، به تنهایی، ساده است، اما از کنار هم قرار گرفتن نوکلئوتیدها، ساختار بلند و پیچیدهای ایجاد میشود که ممکن است DNA خطی یا حلقوی، یا هریک از انواع RNA باشد. در ادامه، تصویری از DNA را مشاهده میکنید. این مولکول از دو رشته تشکیل شده است که به دور یکدیگر پیچیده شدهاند. همانطور که در تصویر مشخص است، بهترین آرایش نوکلئوتیدها در حالتی است که حداکثر تعداد پیوندهای هیدروژنی بین آنها ایجاد شود.
مارپیچ دورشتهای DNA.
پیوند درون هر رشته، از نوع «فسفودیاستری» است که یکی از انواع پیوندهای محکم «کووالانسی »به شمار میرود. دو رشته با پیوندهای هیدروژنی به یکدیگر متصل شدهاند. هرچند این پیوند، به تنهایی، جزو پیوندهای شیمیایی ضعیف به شمار میرود، اما خاصیت تعاونی آن موجب میشود، در مجموع، یک اتصال قوی بین دو رشته، شکل گیرد و آن را به حالت پایدار نگه دارد. تشکیل چنین ساختار پایداری، به دلیل وجود ویژگیهای بیوشیمایی نوکلئوتیدهاست.
هر نوکلئوتید، فقط میتواند با یک نوع نوکلئوتید دیگر، پیوند هیدروژنی برقرار کند(جفت شود). تصویر بالا، پیوند تیمین به آدنین و پیوند گوانین به سیتوزین را نشان میدهد.
اگر رشتهای از نوکلئوتیدها، به همین ترتیب، به رشته دیگری جفت شود، سرانجام، مانند یک زیپ، یک مولکول دو رشتهای بلند، ایجاد میشود که دو زنجیره آن، به دور یک محور فرضی، پیچیدهاند و در تمام طول خود، کاملا صاف و هموار، هستند. اما اگر در ناحیهای از این مولکول، یک نوکلئوتید، با نوکلئوتید مقابل خود، جفت نشود، به صورت یک برامدگی دیده خواهد شد.
یکی از راههایی که پروتئینها میتوانند DNA آسیب دیده را ترمیم کنند، شناسایی و اتصال به این نقطههای برامده موجود در ساختار DNA است. در این حالت، پروتئین ترمیمی، نوکلئوتید غلط را برش داده و آن را جایگزین میکند. ماهیت دورشتهای بودن ساختار ژنوم، تضمین میکند که خطاهای از این دست، با دقت بالایی قابل اصلاح هستند.
در اعضا لنفاوی ثانویه، لنفوسیت های B با سلول های دندریتی فولیکولی پراکنده واکنش نشان می دهند.این سلول ها دارای زوائد فیلامانی بلندی هستند و برخلاف دیگر سلول های دندریتی، دارای منشا مزانشیمی می باشند و عمکرد ان ها وابسته به مولکول های MHC کلاس 2 نیست. سطح این سلول ها توسط کمپلکس آنتی ژن_ آنتی بادی پوشیده شده که به پروتئین های کمپلمان و نواحی Fc ایمونوگلوبولین وصل شده و د رنهایت به سلول های B متصل می شوند و آن ها را فعال می نمایند. نتیجه این اعمال ایجاد گره های لنفاوی کوچک اولیه است. با کمک و همراهی لنفوسیت های T در مجاورت این ساختمان ها ، سلول های B به تدریج گروه های بزرگتری به نام گره های لنفاوی ثانویه را ایجاد می نمایند.
جهش DNA
عوامل جهشزا، موجب تغییر در شکل ظاهری DNA میشوند. پروتئینهای ترمیمی، این نواحی را شناسایی و آنها را ترمیم میکنند.
ساختمان هر پروتئین و نهایتا هر مولکول زیستی، محصول اطلاعات موجود در توالی نوکلئوتیدی ژنوم سلول است. آشنایی با ویژگیهای ساختاری و بیوشیمیایی نوکلئوتیدها، گام نخست در یادگیری مباحث پیچیدهتر علم ژنتیک به شمار میرود.
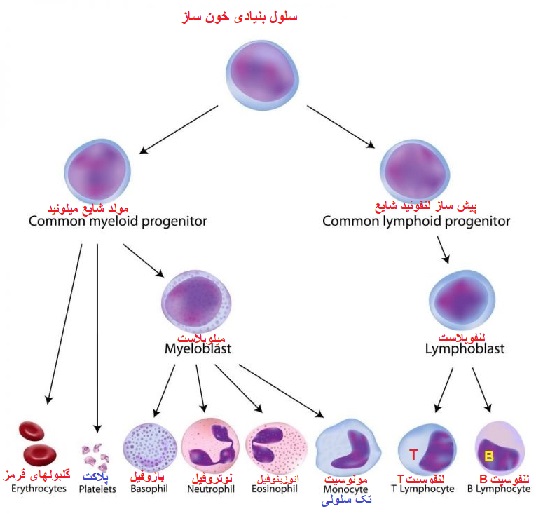
منشا سلول های تک هسته ای خون محیطی
سلول های تک هسته ای خون محیطی از سلول های بنیادی خونساز (HSC) که در مغز استخوان قرار دارند سرچشمه می گیرند. HSC ها از طریق فرایندی به نام خون سازی یا هماتوپوئز باعث تولید کلیه سلول های خونی و سیستم ایمنی بدن می شوند. سلول های بنیادی خونساز، از طریق خونسازی پیشرفت می کنند و سلول های میلوئیدی (مونوسیت ها، ماکروفاژها، گرانولوسیت ها، مگاکاریوسیت ها، سلول های دندریتی، گلبول های قرمز) و لنفوئید (سلول های T، سلول های B، سلول های NK) را تولید می کنند.
درون هر دو رده سلول هایی هستند که PBMC ها را تشکیل می دهند. PBMC ها سلول های خونی با هسته های گرد هستند که جمعیت سلول های ناهمگنی را شامل می شود که شامل جمعیت های مختلف لنفوسیت ها (سلول های T، سلول های B و سلول های NK)، سلول های دندریتیک و مونوسیت ها است. این سلول ها اجزای حیاتی سیستم ایمنی ذاتی و تطبیقی هستند که از بدن در برابر عفونت ویروسی، باکتریایی و انگلی محافظت کرده و سلول های توموری و مواد خارجی را از بین می برند.
فراوانی جمعیت های مختلف سلول ها در PBMC
جمعیت سلول های انسانی در هر فرد متفاوت است، اما به طور متوسط ، بیشتر PBMC ها را لنفوسیت ها تشکیل می دهند. لنفوسیت ها نقش اساسی در پاسخ های ایمنی سلولی و ایمنی هومورال دارند که در درجه اول، با فعال شدن سلول های T و B در ارتباط است.
در جمعیت لنفوسیت ها، سلول های CD3 + T مهمترین بخش سلولی (70-45٪) هستند. اکثر سلول های T به عنوان سلول های T ساده و در حال استراحت وجود دارند. این ها سلول های T هستند که توسط آنتی ژن فعال نشده اند و یا به عنوان سلول های T حافظه عمل می کنند. فعال شدن سلول های T ساده از طریق شناسایی آنتی ژن رخ می دهد و جمعیت کمی از سلول های T را در افراد سالم تشکیل می دهد. سلول های T پس از فعال شدن، یک پاسخ ایمنی سلولی را شروع می کنند که آنتی ژن های درون سلول آلوده یا بیمار را مورد هدف قرار می دهد.
به طور مشابه، سلول های CD19 + B به عنوان سلول های ساده یا حافظه ای وجود دارند که در انتظار فعال شدن توسط آنتی ژن هستند و فقط 5-15٪ از کل جمعیت لنفوسیت ها را تشکیل می دهند. سلول های B پس از فعال شدن، به سلول های پلاسما متمایز می شوند که قادر به ترشح آنتی بادی هایی هستند که به طور خاص آنتی ژن های آزاد گردش یافته در جریان خون را هدف قرار می دهند. توانایی هدف قرار دادن آنتی ژن های آزاد توسط آنتی بادی های ترشحی در فضای خارج سلول به عنوان پاسخ ایمنی هومورال تعریف می شود.
سلول های NK بخش کوچکتری از جمعیت لنفوسیت ها را تشکیل می دهند (5-10٪). این سلول ها بدون نیاز به آنتی ژن عملکرد موثر خود را انجام می دهند و از بدن در برابر فعالیت تومور دفاع می کنند.
بخش کوچکی از گلبول های سفید شامل سلول های دندریتیک (1-2٪) است که یک رابط حیاتی بین سیستم ایمنی ذاتی و سازگار را تشکیل می دهد. سلول های دندریتیک، یک سلول ارائه دهنده آنتی ژن بسیار تخصصی، آنتی ژن ها را بلعیده و قطعات آنتی ژنی را به سلول های سیستم ایمنی تطبیقی ارائه می دهد که باعث فعال شدن سلول های T و B می شود.
«مونوسیت» ها از نظر پیچیدگی و اندازه با «لنفوسیت» ها متفاوت اند.، مونوسیت ها (10-30٪) در جریان خون و بافت محیطی گردش می کنند و هنگامی که تحریک می شوند، بالغ می شوند و به سلول های «دندریتیک»(ماکروفاژها) متمایز می شوند که به عملکرد پاسخ های ایمنی ذاتی و اکتسابی کمک می کنند و به عنوان سلول های «فاگوسیتیک»(گلبول های سفید خون) و ارائه دهنده آنتی ژن عمل می کنند.
سلول های بنیادی خون ساز
«سلول های بنیادی خونساز» از اهمیت بسیار بالایی برخوردارند.
HSC ها در خون و مغز استخوان باعث تولید کلیه سلول های موجود در خون از جمله گلبول های قرمز خون، پلاکت ها، لنفوسیت ها، مونوسیت ها و گرانولوسیت ها می شوند. برای پیوند سلول های بنیادی، جمعیت این سلول نادر است و فقط 0.1-0.2٪ از بخش PBMC را تشکیل می دهد و جدا کردن آن ها از نمونه های خون کامل دشوار است.
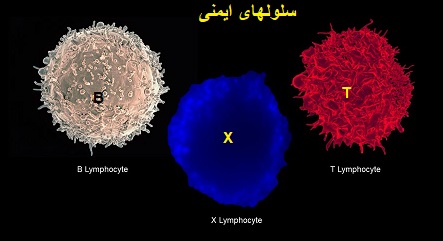
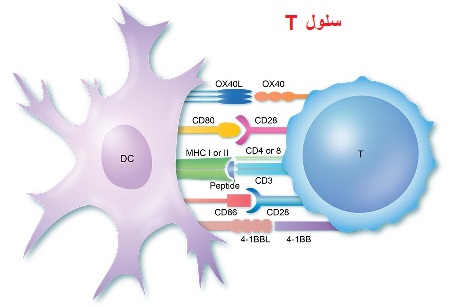
«سلول T» چیست؟
«سلول T»نوعی لنفوسیت یا گلبول سفید است.
مغز استخوان سلولهای T را به شکل سلولهای نمونه تولید میکند و آنها به غده ی T موس می روند که به آن «سلول T» می گویند.
جداسازی سلول های تک هسته ای خون محیطی
دو روش اصلی برای جداسازی سلول های تک هسته ای خون محیطی از خون کامل وجود دارد. به کمک استفاده از سانتریفوژ توسط ایجاد شیب تراکم یا با استفاده از لوکافر.
از آنجا که سلول ها دارای تراکم خاصی هستند، استفاده از فرآیند سانتریفیوژ با شیب تراکم، جمعیت سلول های اصلی مانند لنفوسیت ها، مونوسیت ها، گرانولوسیت ها و سلول های قرمز خون را از طریق ایجاد یک شیب تراکمی جدا می کند. برای سلول های انسانی، تراکم محیط 1.077 گرم در میلی لیتر امکان جداسازی کافی PBMC ها (تراکم 1.077 گرم در میلی لیتر) از سلولهای قرمز خون و گرانولوسیت ها (تراکم> 1.077 گرم در میلی لیتر) را فراهم می کند. پس از سانتریفیوژ، PBMC به عنوان یک لایه سفید نازک بین پلاسما و محیط ایجاد کننده شیب چگالی ظاهر می شود که جداسازی آن ها را آسان می کند.
دستگاه leukapheresis وسیله ای خودکار است که با استفاده از سانتریفیوژ با سرعت بالا، PBMC را از خون کامل جدا می کند.
توضیح مدیریت سایت-پیراسته فر: برای اطلاع جامع ازفنآوری «کریسپر» به این لینک مراجعه کنید: