پیراسته فر
علمی،تحقیقی و تحلیلیپیراسته فر
علمی،تحقیقی و تحلیلیدستکاری درژنها DNAویرایش ژنها،تولدموجودات زنده وانسانها
editing human embryos (ویرایش جنین انسان)
فنآوری«کریسپر»به دانشمندان اجازه میدهد که DNA هر ژنوم را ویرایش کنند و خصوصیات یک ارگانیسم را بهطورکلی تغییر دهند.
«کریسپر» یا «قیچی ژنتیکی»(قیچی مولکولی) یک روش درمانی پیشرفته برای ویرایش ژن است که در حوزه درمان بیماریهای لاعلاج کاربرددارد.
اصلاح یا «ویرایش ژن» یک فناوری خاص و جدید است، روش «جابه جایی، برش و تنظیم ژن» است که میتواند برای درمان بیماریها،« افزایش طول عمر و اصلاح ژنی نوزادان» مورد استفاده قرار گیرد.
این فناوری ، اولین بار در سال ۱۹۸۷میلادی(۱۳۶۶شمسی) و توسط یک گروه تحقیقاتی ژاپنی معرفی و اجرا شد. هرچند تکمیل این فرایند پزشکی تا سال ۱۹۹۳(میلادی(۱۳۷۲شمسی)طول کشید ولی از آن سال بود که مفهوم کلی ویرایش ژنی مورد توجه پزشکان و محققان قرار گرفت.
با این فناوری میشود انواع گیاهان، حیوانات و دیگر مواد غذایی مورد نظر انسان را مهندسی کرد. میتوان گوسفندانی تولید کرد که تا چندین برابر گوشت تولید کنند و یا میوههایی را به تولید رساند که در برابر آفتها مقاوم هستند و سطح عملکرد بالایی دارند.
این فناوری همچنین به کمک درمان بسیاری از بیماریها از جمله سرطان آمده و پزشکان امیدوارند در آیندهای نه چندان دور با این تکنیک روشهای درمانی برای بیماریهای لاعلاج ارائه دهند.
«کریسپر»(CRISPR)، فناوری پیشرفتهای است که میتوان از آن برای ویرایش ژن استفاده کرد و شاید همین ویژگی آن بتواند جهان را متحول کند.
«کریسپر»(CRISPR)، فناوری پیشرفتهای است که میتوان از آن برای ویرایش ژن استفاده کرد و شاید همین ویژگی آن بتواند جهان را متحول کند.
«کریسپر»(CRISPR) مخفف«Clustered Regularly Interspaced Short Palindromic Repeats» به معنی «تناوبهایِ کوتاهِ پالیندرومِ فاصلهدارِ منظمِ خوشهای» بخشی از «دیانای»(DNA) «پروکاریوت»(prokaryote) هستند که حاوی «تناوبهای کوتاهِ توالیهای بنیادین» هستند. بخشی از سیستم کریسپر «پروتئین Cas۹» است. این پروتئین قابلیت جستجو، برش زدن و تغییر دی ان ای(DNA) را دارد. قبل از این تکنیک از روش «تحویل یا انتقال ژن» استفاده میشد، به این صورت که از یک ناقل ویروسی یا غیرویروسی برای انتقال ژن سالم به ژنوم سلول میزبان استفاده میشد، ولی در روش کریسپر، ژن معیوب برش داده میشود و ژن سالم به جای آن قرار میگیرد. استفاده از «آنزیم Cas۹» خطر کمتری نسبت به روش قبلی که یک ژن خارجی وارد« ژنوم »(genome)میشد دارد، زیرا گاهی ژن خارجی به سرطان منجر میشود اما ژنی که از طریق کریسپر ترمیم شود کنترل شده است.
نام دیگر این تکنیک «قیچی ژنتیکی» است که به دلیل ساز و کار آنزیم «کَس۹» CRISPR-Cas۹ هست. این آنزیم به عنوان یک جفت «قیچی مولکولی» میتواند دو رشته DNA را در محل خاصی از ژنوم برش دهد.
ماهیت «کریسپر»، ساده است. این فناوری، راهی است که به یافتن بخش مشخصی از DNA درون سلول کمک میکند. مرحله بعدی در روش «ویرایش ژن کریسپر» معمولاً تغییر دادن همان بخش DNA است.
«پیش از رونمایی از روش کریسپر»، روشهایی برای ویرایش ژنوم برخی از گیاهان و جانوران وجود داشت اما این روشها سالها زمان میبردند و صدها هزار دلار هزینه داشتند. کریسپر کمک کرد تا این کار، کمهزینه و ساده شود.
«کریسپر»در حال حاضر به صورت گسترده در پژوهشهای علمی به کار میرود و احتمالا به زودی بسیاری از گیاهان و حیوانات به واسطه آن دچار تغییر میشوند. در واقع، در حال حاضر هم برخی از مردم، غذاهایی را مصرف میکنند که با فناوری کریسپر تغییر یافتهاند.
توضیح مدیریت سایت-پیراسته فر:برای اطلاع ازسازوکارهای«ژنوم»به این لینک مراجعه کنید:
Genomeژنوم چیست؟DNA
فناوری «کریسپر»، قابلیت تغییر دادن دارو را نیز دارد و به پژوهشگران کمک میکند تا نه تنها بسیاری از بیماریها را درمان کنند، بلکه بتوانند به پیشگیری از آنها بپردازند. حتی شاید بتوانیم این فناوری را برای «تغییر ژنوم» فرزندان خود به کار بگیریم. تلاش برای انجام دادن این کار در چین، به عنوان یک کار غیراخلاقی شناخته شده است اما برخی باور دارند که این کار در آینده میتواند به نفع کودکان باشد.
کریسپر برای اهداف دیگری نیز استفاده میشود؛ از «انگشتنگاری سلولها»(ثبت وقایع درون سلولها) گرفته تا هدایت تکامل و ترغیب ژنها.
کلید «کریسپر»، پروتئین «کَس۹»(Cas۹) است که به صورت گسترده مورد استفاده دانشمندان قرار میگیرد. این پروتئین را میتوان به سادگی برنامهریزی کرد تا توالی مورد نظر را پیدا کند و به آن متصل شود.
هنگامی که «پروتئین کَس۹» به همراه بخشی ازRNA راهنما به سلول اضافه میشود، به آرانای راهنما متصل میشود و سپس در امتداد رشتههای DNA حرکت میکند تا به دنبالهای طولانی از DNA برسد که با بخشی از توالی آرانای مطابقت دارد و سپس به آن متصل شود.
«پروتئین استاندارد کَس۹» در محل مورد نظر از DNA برش ایجاد میکند. هنگامی که برش ترمیم میشود، جهشهایی پدید میآیند که معمولا یک ژن را غیرفعال میکنند. این رایجترین کاربرد کریسپر است که به آن «ویرایش ژنوم» یا «ویرایش ژن »گفته میشود.
«کریسپر» را میتوان برای ایجاد تغییرات دقیق مانند جایگزینی ژنهای معیوب مورد استفاده قرار داد اما این کار بسیار دشوارتر است.
«کریسپر» یک فناوری ویرایش ژن است که آمادگی دارد تا انقلابی را در پزشکی ایجاد کند.
پژوهشگران سعی دارند درمانهای مبتنی بر کریسپر را برای طیف وسیعی از بیماریها از جمله بیماریهای موروثی چشم، بیماریهای عصبی مانند آلزایمر و هانتینگتون و بیماریهایی مانند سرطان و ایدز ارائه دهند. در حقیقت، آزمایشهای کریسپر روی بسیاری از این بیماریها در حال انجام شدن است.
چگونه می توان از «کریسپر» برای درمان بیماریها استفاده کرد؟
پژوهشگران با استفاده از فناوری کریسپر میتوانند هر بخشی از DNA مورد نظر را به طور دقیق ویرایش کنند. این کار پیشتر با استفاده از سایر ابزارهای ویرایش ژن، قابل دستیابی نبود. امکان ویرایش جهش بیماری برای تصحیح خطاهای ژنتیکی، فرصتهایی را برای درمان آن دسته از بیماریها ارائه میدهد که مدتهاست از نتایج پژوهشهای پزشکی فرار کردهاند.
کریسپر میتواند تعدادی از بیماریهای ژنتیکی را درمان کند؛ از بیماریهای خونی مانند کمخونی داسی شکل گرفته تا سرطان. فهرست بیماریهایی که پژوهشگران در حال حاضر سعی دارند با کمک فناوری کریسپر با آنها مبارزه کنند، روز به روز در حال افزایش است. دادههای حاصل از آزمایشهای بالینی منتشر شده نشان داده است که کریسپر در درمان بیماران مبتلا به کمخونی داسی شکل و همچنین تالاسمی بتا موفق بوده است.
با توجه به توسعه این فناوری ویرایش که امکان درج،
حذف و تغییر دادن بخشهای مورد نظر ژنوم را فراهم میکند، دانشمندان تمایل
دارند که یک ابزار جدید را به حوزه ویرایش ژنوم اضافه کنند و برای ارائه
گزینههای درمانی بیشتر امیدوار هستند.
کاربرد «کریسپر» در درمان سرطان
با موفقیتهای اخیر «کریسپر »در آزمایشهای بالینی مربوط به درمان چندین بیماری، مردم بیش از هر زمان دیگری در مورد این فناوری، هیجانزده شدهاند و درباره این پرسش فکر میکنند که آیا کریسپر میتواند سرطان را درمان کند؟ پژوهشهای بسیاری برای پاسخ دادن به این پرسش، در حال انجام شدن است.
در اینجا به برخی از پژوهشهایی میپردازیم که دانشمندان حوزه سرطان آنها را انجام دادهاند و امیدوارند که بتوانند با کمک فناوری کریسپر، این بیماری را در انسان درمان کنند.
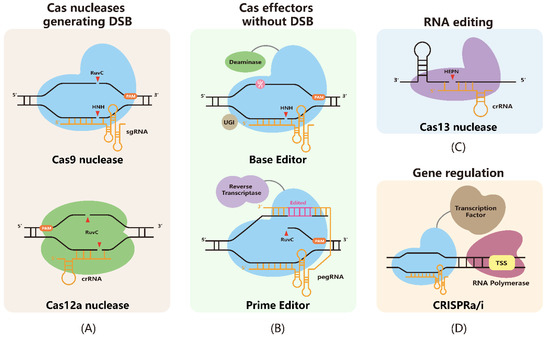
ابزارهای مبتنی بر CRISPR برای کاربردهای مختلف مهندسی.
(A) نوکلئازهای Cas، از جمله نوکلئاز Cas9 و نوکلئاز Cas12a، DSB (شکستگی های دو رشته ای) را در مکان های هدف ایجاد می کنند. پس از اتصال با sgRNA ها (RNA های راهنمای منفرد) یا crRNA ها (RNA های CRISPR)، نوکلئازهای Cas توالی DNA هدف مجاور توالی PAM (پرتو اسپیسر مجاور موتیف) را تشخیص داده و هدف DNA را برش می دهند.
(B) BE (ویرایشگرهای پایه) و PE (ویرایشگرهای اصلی) بدون تولید DSB به مهندسی توالی دست می یابند. BEها به ترتیب از دآمینازها برای دآمینه کردن C یا A به U یا I استفاده می کنند. بر این اساس، فرآیند بازسازی و تکثیر DNA بعدی، نوکلئوتیدهای دآمینه شده را به T یا G مورد نظر منتقل می کند.
PEs از pegRNA 3'-گسترده (RNA راهنمای ویرایش اصلی) برای نصب توالی مورد نظر در مکان هدف استفاده می کنند. این افکتورها از nCas9s استفاده میکنند تا DNA هدف را برای کارایی ویرایش بالاتر برش دهند.
(C) نوکلئازهای Cas13 با crRNA ها برای هدف قرار دادن و جدا کردن RNA ها کار می کنند. قابل ذکر است، اعضای مختلف خانواده Cas13 جهت گیری های crRNA متفاوتی دارند (نشان داده نشده است).
(D) افکتورهای CRISPR a/i (فعال سازی/تداخل) فاکتورهای رونویسی را به سیستم های dCas9 برای تنظیم ژن هدفمند بدون تغییر توالی DNA جذب می کنند.
برای استفاده از ابزار مبتنی بر«CRISPR» در عمل درمانی، سیستم تحویل برای ویرایش کارآمد بسیار مهم است. سیستم CRISPR را می توان به ترتیب در شرایط خارج از بدن به سلول های جدا شده یا در داخل بدن به موجودات زنده تحویل داد . در همین حال، می توان آن را به اشکال مختلف تحویل داد:
(۱) DNA کد کننده Cas effector و sgRNA. (۲) mRNA که عامل Cas و sgRNA بیان شده را کد می کند. (۳) کمپلکس RNP (ریبونوکلئوپروتئین) متشکل از عامل Cas و sgRNA [86]. تحویل DNA دارای زمان فعال طولانی، زمان شروع آهسته است و در سناریوهای خاصی نیاز به ادغام ژنوم دارد.
اگرچه mRNA و sgRNA زمان شروع نسبتا کوتاه و زمان متوسط فعال دارند، این نوع تحویل پرهزینه و پایدارتر است. تحویل RNP سریعترین اثر را دارد و برای جهشهای خارج از هدف پایینتر گذرا است . استراتژی های تحویل شامل تحویل فیزیکی، تحویل شیمیایی غیر ویروسی، ناقل های ویروسی و ذرات ویروس مانند (VLP) و غیره است (شکل ۲).
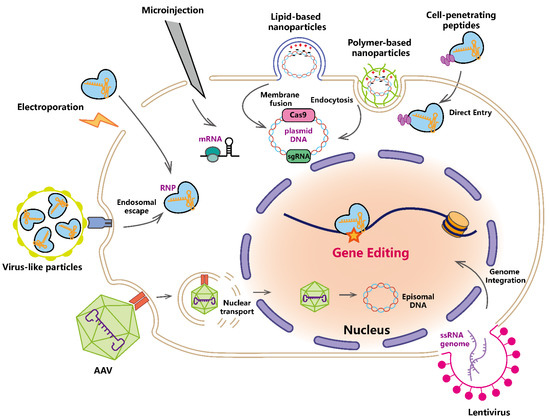
شکل ۲. سیستم های تحویل محموله های CRISPR-Cas.
تحویل فیزیکی از الکتروپوریشن و میکرو تزریق برای تحویل مستقیم سیستمهای CRISPR به شکل پلاسمید DNA، mRNA یا RNP (ریبونوکلئوپروتئین) به سلولها استفاده میکند. نانوذرات مبتنی بر لیپید با بار مثبت و نانوذرات مبتنی بر پلیمر، محمولههای بار منفی محصور شده را از طریق همجوشی غشا و اندوسیتوز به سلولها منتقل میکنند. پپتیدهای نافذ به سلول، ورود مستقیم RNP های ذوب شده به سلول ها را واسطه می کنند. Lentivirus و AAV (ویروس مرتبط با آدنو) معمولاً از سیستمهای انتقال ویروس استفاده میشوند. لنتی ویروس تحت رونویسی معکوس قرار می گیرد و برای رونویسی بعدی در ژنوم ادغام می شود. AAV تحت فرار آندوزومی قرار می گیرد و ژنوم آزاد شده به هسته منتقل می شود و به عنوان DNA اپیزومی باقی می ماند. ذرات ویروس مانند می توانند به طور موقت RNP ها را با زمان شروع سریع به سلول ها برسانند. تأثیرگذارهای Cas تحویل یا ترجمه شده ویرایش ژن را در جایگاه های هدف در هسته واسطه می کنند. لطفا توجه داشته باشید که محموله های تحویلی و مکانیسم ورود سلول به طور کامل برای هر سیستم تحویل ارائه نشده است.
لوسمی حاد لنفاوی سلول B
«لوسمی حاد لنفاوی سلول B» نوعی سرطان است که مغز استخوان طی آن، سلولهای ایمنی نارس موسوم به «لنفوسیتها»(Lymphocytes) را بیش از اندازه تولید میکند. این نوع سرطان معمولا در دوره کودکی و همراه با تب و کبودی ظاهر میشود.
این نوع سرطان، بسیار سریع گسترش مییابد و حتی اگر زود تشخیص داده شود، اغلب نسبت به شیمیدرمانی واکنش نشان نمیدهد. برای درمان این بیماری معمولا به پیوند سلول بنیادی نیاز است که بسیاری از بیماران به آن دسترسی ندارند.
یکی از پژوهشهای مربوط به این زمینه، توسط «واسیم قاسم»(Waseem Qasim)، پژوهشگر "کالج دانشگاهی لندن"(University College London) انجام شد. قاسم در این پژوهش، آزمایشهایی را با استفاده از روشهای ویرایش ژن کریسپر و با هدف بهبود درمان با «سلولهای تی کایمریک گیرنده آنتیژن»(CAR T cells) انجام داد. تمرکز او بر استفاده از این روشها برای درمان کودکان بیمار مبتلا به لوسمی حاد لنفاوی سلول B است.
بررسی دیگری که توسط پژوهشگران چینی و به سرپرستی «هان ویدانگ»(Han Weidong)، "پژوهشگر بیمارستان نظامی ۳۰۱"(۳۰۱ Military Hospital) انجام شده است، فناوری کریسپر را برای مهندسی کردن سلولهای ایمنی بیماران به کار میگیرد تا بتوانند سلولهای سرطانی را که پروتئین "CD19" را بیان میکنند، هدف قرار دهند و از بین ببرند. پژوهشگران در آزمایش بالینی این پروژه سعی دارند درمان با سلولهای تی کایمریک گیرنده آنتیژن را در بیماران مبتلا به لوسمی حاد لنفاوی سلول B به کار بگیرند. آنها نشان دادهاند که این بیماری با بیان پروتئین CD19 مرتبط است.
نتایج این آزمایشهای بالینی، تاثیر درمان با سلولهای تی کایمریک گیرنده آنتیژن را نشان خواهند داد. پیامدهای درمان سرطان با کمک فناوری کریسپر باید پیش از به کارگیری گسترده آن در حوزه درمان، بررسی و تایید شود.
سرطانهای ریه و مری
درمان «سرطان مری» مانند انواع خاصی از سرطان ریه، چالش برانگیز است. به ویژه، بسیاری از سرطانهای ریه در برابر شیمیدرمانی، مقاوم هستند و سرطان مری اغلب در اواخر مرحله پیشروی خود تشخیص داده میشود و ضعف پیامدهای درمان را در پی دارد.
در بسیاری از سرطانها از جمله سرطان ریه و مری، رشد تومور مستقیما با پروتئین "PD-1" همراه است. این پروتئین که روی سطح سلولها قرار دارد، واکنش ایمنی طبیعی بدن را تنظیم میکند.
در یک روش مبتنی بر کریسپر که توسط «جوانهویی کای»(Juanhui Cai)، پژوهشگر "دانشگاه علوم پزشکی هبی"(Hebei Medical University) چین ابداع شده است، PD-1 به منظور افزایش فعالیت ضد توموری سلول تی، در سلولهای بیماران مبتلا به سرطان حذف میشود.
یک کارآزمایی بالینی که به تازگی به پایان رسیده، ژن درمانی مبتنی بر کریسپر را در بیماران مبتلا به «سرطان ریه سلول غیر کوچک»(NSCLC) بررسی کرده است. این بررسی نشان داد که کاربرد بالینی سلولهای تی ویرایش شده با فناوری کریسپر، ایمن و امکانپذیر است.
همچنین این روش درمانی مبتنی بر کریسپر، یک روش ایدهآل برای درمان موثر سرطان مری است. نتایج برخی از این آزمایشهای بالینی نشان داده است که درمان مبتنی بر کریسپر میتواند برای درمان سرطان ریه و مری، بدون خطر و امکانپذیر باشد. پیش از این که درمان به طور گسترده در دسترس قرار بگیرد، باید اثرات بلندمدت و اثرات خارج از هدف آن ارزیابی شوند.
مولتیپل میلوما
«مولتیپل میلوما»(Multiple Myeloma)، نوعی از سرطان است که در مغز استخوان ایجاد میشود و با بروز ناهنجاریهایی در سلولهای پلاسما همراه است. این ناهنجاریها باعث میشوند که سلولهای پلاسما، به صورت خارج از کنترل تکثیر شوند و تومورهایی را در استخوان ایجاد کنند.
درمان مولتیپل میلوما با کمک فناوری کریسپر، ایمنی و اثربخشی یک روش مبتنی بر کریسپر موسوم به "CTX120" را در افراد مبتلا به انواع عود کننده یا مقاوم مولتیپل میلوما را مورد بررسی قرار میدهد. پیشبینی میشود که بررسی افزایش دوز و ارزیابی منسجم این روش، در اوایل سال ۲۰۲۷ به پایان برسد.
پژوهشی که در شرکت زیستفناوری«Allogene» در حال انجام شدن است، اثربخشی یک روش درمانی موسوم به "ALLO-605" را مورد بررسی قرار میدهد که در حال حاضر در مراحل پیشبالینی به سر میبرد.
نتایج کارآزمایی بالینی CTX120، اثربخشی و کارآیی درمانهای مبتنی بر کریسپر را تعیین خواهد کرد. اثرات بلندمدت و خارج از هدف این درمان باید پیش از تجویز گسترده درمان مورد بررسی و رسیدگی قرار بگیرند. روش ALLO-۶۰۵ به احتمال زیاد چند سال زمان خواهد برد تا به آزمایشهای بالینی در مقیاس بزرگتر برسد که روی انسان انجام میشوند.
سرطان دهانه رحم
«ویروس پاپیلوم انسانی»(HPV)، عامل ۷۰ درصد از سرطانهای دهانه رحم است. در حال حاضر واکسنی وجود دارد که از انسانها در برابر ابتلا به ویروس پاپیلوم انسانی محافظت میکند اما هنوز روشی برای درمان بیماران مبتلا به آن در دسترس نیست.
پژوهشگران در حال حاضر سعی دارند فناوری کریسپر را به عنوان روشی برای از بین بردن ویروس پاپیلوم انسانی مورد استفاده قرار دهند.
پژوهشی که به سرپرستی «هو ژنگ»(Hu Zheng)، پژوهشگر "دانشگاه سون یات سن"(SYSU) انجام شده است، فناوری کریسپر را برای هدف قرار دادن ژنهای ویروس «پاپیلوم انسانی»(Human papilloma) و از بین بردن ویروس مورد استفاده قرار میدهند.
یک گروه پژوهشی دیگر به سرپرستی «نیگل مک میلان»(Nigel McMillan)، پژوهشگر حوزه سرطان «دانشگاه گریفیت»(Griffith University)، از فناوری کریسپر برای خاموش کردن «آنکوژن» (E۷) استفاده کردند که ویروس «پاپیلوم انسانی» را به سلولهای میزبان میرساند.
«مک میلان» و گروهش، گروهی از آرانایهای هدایت کننده را ساختند که این «آنکوژن» را هدف قرار میدهند و آنها را به خون موشهایی که تومور داشتند، تزریق کردند. آنها دریافتند که تومورها در موشهایی که هفت تزریق دریافت کرده بودند، به طور کامل ناپدید شدهاند.
پیش از به کارگیری این روش در آزمایشهای بالینی، باید پیامدهای بلندمدت ویرایش و اثرات خارج از هدف آن ارزیابی شوند. در حال حاضر، هیچ آزمایش بالینی برای این روش برنامهریزی نشده است.
دانشمند چینی به جرم دستکاری ژنتیکی انسان به زندان محکوم شد
علیرعم ممنوعیت دستکاری ژنتیکی انسان در چین ، «هی ژیانکوی» برای ایجاد مصونیت در مقابل ویروس اچآیوی(HIV)، ژنهای دو نوزاد را دستکاری کرده بود.
BBC (۹ دی ۱۳۹۸)نوشت:این دانشمند نوامبر سال گذشته میلادی از به دنیا آمدن یک دوقلو با ژن دستکاری شده خبر داد که با واکنش منفی جهانی رو به رو شد. خبرگزاری شینهوا گزارش کرده که نوزاد سومی هم همزمان به دنیا آمده اما اعلام نشده بود. دولت محلی استان گوانجونگ میگوید نوزادان تحت مراقبت پزشکی قرار گرفته بودند.
این دانشمند علاوه بر زندان به پرداخت سه میلیون یوآن برابر با ۴۳۰ هزار دلار هم محکوم شده است. دادگاه همچنین دو مرد دیگر را به نامهای« ژانگ رنلی» و «کین جینژو »برای همدستی با «هی ژیانکوی» مجرم شناخته است.
دادگاه شهر شنژن گفت این افراد برای شهرت و منفعت شخصی، به پایینترین حد اخلاق تحقیقات علمی و اخلاق پزشکی تنزل کردهاند.
آقای «هی ژیانکوی» چکارکرده بود؟
«هی ژیانکوی» در ویدئویی که آسوشیتدپرس در نوامبر ۲۰۱۸ ضبط کرده بود خبر از تولد دوقلویی به نام «لولا و نانا» داد که ژنهایشان دستکاری شده بود. او گفت: «من میفهم که کارم جنجالبرانگیز خواهد بود ولی باور دارم که خانوادهها به این فناوری نیاز دارند و من میخواهم بخاطر آنها انتقادها را به جان بخرم».
پس از انتشار این ویدئو، جوامع علمی داخل و خارج چین بسرعت واکنشهای منفی شدیدی نشان دادند. پلیس تحقیق در این باره را آغاز کرد، از آقای«هی ژیانکوی» خواسته شد کار پژوهشیاش را متوقف کند و از دانشیاری دانشگاه علوم و فناوری جنوب شنژن اخراج شد. آکادمی علوم چین بیانیهای صادر و در آن قاطعانه با دستکاری ژنتیکی انسان مخالفت کرد.
پژوهشهای بعدها ،این احتمال را مطرح کردند که این دستکاری ژنتیکی از طول عمر این دو کودک به طرز قابل توجهی میکاهد.
آقای «هی ژیانکوی» ژنی به نام سیسیآر ۵ (CCR5)را هدف قرار داده که مجموعهای دستورالعملهای ژنتیکی است و در عملکرد سیستم ایمنی اهمیت دارد. ویروس اچآیوی برای ورود به سلول از همین راه استفاده میکند. جهش سیسیآر ۵ سبب مسدود شدن این مسیر و مقاومت انسان در برابر اچآیوی میشود.
اصلاح ژن چیست؟
این دانشمند چینی از هفت زوج غیرهمجنسگرا که فرزند میخواستند دعوت کرده بود در پژوهشش شرکت کنند. تمام مردان مبتلا به اچآیوی بودند اما زنها نه.
آقای «هی ژیانکوی» در کلینک باروری جنین این زوجها را تولید و از فناوری CRISPR-Cas9 برای تغییر ژن سیسیآر ۵ آنها بهره برد.
بعد مدارکی جعلی برای دور زدن مرحله اجباری بررسی اخلاقی ارائه کرد و با اطلاعاتی ساختگی سبب شد پزشکان بدون اینکه بدانند، جنینهایی را که ژنهایشان دستکاری شده بود در رحم دو زن قرار دهند.
عواقب دستکاری ژنتیکی جنین انسان روشن نیست ولی هر چه باشد آثارش دائمی است. هرگونه دستکاری ژنتیکی به نسلهای بعدی منتقل میشود و بر نوع بشر اثر میگذارد.
نسخه اصلی پژوهش این دانشمند اولینبار اوایل ماه جاری میلادی منتشر شد. دانشمندان دیگر گفتند که نتایج، آنچه را که آقای ژیانکوی میگوید نشان نمیدهد. این دانشمندان بر این باورند که آقای ژیانکوی ژنِ درست را هدف قرار داده اما جهشی را که باعث مصونیت در مقابل اچآیوی میشود ایجاد نکرده، در عوض ژن دستکاری شدهای تولید کرده که تا به حال دیده نشده و عوارضش نامعلوم است.
دانشمند چینی به جرم دستکاری ژنتیکی انسان به زندان محکوم شد
علیرعم ممنوعیت دستکاری ژنتیکی انسان در چین ، هی ژیانکوی برای ایجاد مصونیت در مقابل ویروس اچآیوی(HIV)، ژنهای دو نوزاد را دستکاری کرده بود.
BBC (۹ دی ۱۳۹۸)نوشت:این دانشمند نوامبر سال گذشته میلادی از به دنیا آمدن یک دوقلو با ژن دستکاری شده خبر داد که با واکنش منفی جهانی رو به رو شد. خبرگزاری شینهوا گزارش کرده که نوزاد سومی هم همزمان به دنیا آمده اما اعلام نشده بود. دولت محلی استان گوانجونگ میگوید نوزادان تحت مراقبت پزشکی قرار گرفته بودند.
این دانشمند علاوه بر زندان به پرداخت سه میلیون یوآن برابر با ۴۳۰ هزار دلار هم محکوم شده است. دادگاه همچنین دو مرد دیگر را به نامهای« ژانگ رنلی» و «کین جینژو »برای همدستی با «هی ژیانکوی» مجرم شناخته است.
دادگاه شهر شنژن گفت این افراد برای شهرت و منفعت شخصی، به پایینترین حد اخلاق تحقیقات علمی و اخلاق پزشکی تنزل کردهاند.
آقای «هی ژیانکوی» چکارکرده بود؟
«هی ژیانکوی» در ویدئویی که آسوشیتدپرس در نوامبر ۲۰۱۸ ضبط کرده بود خبر از تولد دوقلویی به نام لولا و نانا داد که ژنهایشان دستکاری شده بود. او گفت: «من میفهم که کارم جنجالبرانگیز خواهد بود ولی باور دارم که خانوادهها به این فناوری نیاز دارند و من میخواهم بخاطر آنها انتقادها را به جان بخرم».
پس از انتشار این ویدئو، جوامع علمی داخل و خارج چین بسرعت واکنشهای منفی شدیدی نشان دادند. پلیس تحقیق در این باره را آغاز کرد، از آقای«هی ژیانکوی» خواسته شد کار پژوهشیاش را متوقف کند و از دانشیاری دانشگاه علوم و فناوری جنوب شنژن اخراج شد. آکادمی علوم چین بیانیهای صادر و در آن قاطعانه با دستکاری ژنتیکی انسان مخالفت کرد.
پژوهشهای بعدها ،این احتمال را مطرح کردند که این دستکاری ژنتیکی از طول عمر این دو کودک به طرز قابل توجهی میکاهد.
آقای «هی ژیانکوی» ژنی به نام سیسیآر ۵ (CCR5)را هدف قرار داده که مجموعهای دستورالعملهای ژنتیکی است و در عملکرد سیستم ایمنی اهمیت دارد. ویروس اچآیوی برای ورود به سلول از همین راه استفاده میکند. جهش سیسیآر ۵ سبب مسدود شدن این مسیر و مقاومت انسان در برابر اچآیوی میشود.
اصلاح ژن چیست؟
این دانشمند چینی از هفت زوج غیرهمجنسگرا که فرزند میخواستند دعوت کرده بود در پژوهشش شرکت کنند. تمام مردان مبتلا به اچآیوی بودند اما زنها نه.
آقای «هی ژیانکوی» در کلینک باروری جنین این زوجها را تولید و از فناوری CRISPR-Cas9 برای تغییر ژن سیسیآر ۵ آنها بهره برد.
بعد مدارکی جعلی برای دور زدن مرحله اجباری بررسی اخلاقی ارائه کرد و با اطلاعاتی ساختگی سبب شد پزشکان بدون اینکه بدانند، جنینهایی را که ژنهایشان دستکاری شده بود در رحم دو زن قرار دهند.
عواقب دستکاری ژنتیکی جنین انسان روشن نیست ولی هر چه باشد آثارش دائمی است. هرگونه دستکاری ژنتیکی به نسلهای بعدی منتقل میشود و بر نوع بشر اثر میگذارد.
نسخه اصلی پژوهش این دانشمند اولینبار اوایل ماه جاری میلادی منتشر شد. دانشمندان دیگر گفتند که نتایج، آنچه را که آقای ژیانکوی میگوید نشان نمیدهد. این دانشمندان بر این باورند که آقای ژیانکوی ژنِ درست را هدف قرار داده اما جهشی را که باعث مصونیت در مقابل اچآیوی میشود ایجاد نکرده، در عوض ژن دستکاری شدهای تولید کرده که تا به حال دیده نشده و عوارضش نامعلوم است./پایان.
»He Jiankui« ژنی به نام CCR5 را هدف قرار می دهد که مجموعه دستورات ژنتیکی است که در عملکرد سیستم ایمنی مهم است.
بیوفیزیکدان چینی «هی جیانکوی »در اجلاس علمی بین المللی در دانشگاه هنگ کنگ در نوامبر 2018 در مورد آزمایش بحث برانگیز خود با استفاده از ویرایش ژنوم برای ایجاد نوزادان دوقلو مصون از HIV صحبت می کند.
در نوامبر گذشته ، یک بیوفیزیکدان چینی با اعلام اینکه اولین نوزادان دارای ویرایش ژنی در جهان را تولید کرده است ، جهان را شوکه کرد. وی جیانکوی گفت که از لقاح آزمایشگاهی (IVF) و یک فناوری ویرایش ژن جدید برای تغییر دو جنین انسان استفاده کرده است تا ژنی را که اجازه می دهد ویروس HIV ، که باعث ایدز می شود ، وارد سلول ها شود ، غیر فعال کند.
به گفته وی ، کارآزمایی بالینی با موفقیت ایمنی بدن را در برابر ایدز برای دو دختر دوقلو که پدرشان HIV مثبت بود ، فراهم کرد. دولت چین تولد نوزادان را تایید کرده است.
«ریما مندونسا»(Rima Mendonsa) ، فوق تخصص، در موسسه «نوآورانه ژنومیک»( Innovative Genomics) در دانشگاه کالیفرنیا ، برکلی ، کشت باکتری های مایع را آماده می کند تا نسخه خاصی از CRISPR ، یک ابزار انقلابی ویرایش ژن را بسازد.
در حال حاضر ، آمریکا و حدود ۳۰ کشور دیگر ، از جمله چین ،به فنآوری «تغییر ژن در جنین انسان برای تولد نوزاد » روشی به نام ویرایش «ژرم ژل انسان»(human germline)«خط ژرمنی انسان»دست یافته اند.«دکترریما مندونسا »،در موسسه نوآورانه ژنومیک در دانشگاه کالیفرنیا ، برکلی درحال آزمایش ،تغییرات ژنتیکی،دستکاریDNA
تولدسگ بادستکاری درژن /ویرایشDNA ژنومرادیوفردا(۳آبان۱۳۹۴)با استفاده از مهندسی ژنتیک، دانشمندان چینی موفق به پرورش سگی با ماهیچه و قدرتی دو برابر سگهای معمولی شدهاند. به گزارش مجله دانشگاه فنآوری ماساچوست، این دانشمندان با از بین بردن پروتئین مخصوصی در بدن یک نوع سگ، میزان ماهیچههای او را دو برابر کردند.
این سگهای جهشیافته «ماهیچههای بیشتری دارند و انتظار میرود که قدرت دوندگی بیشتری داشته باشند که آنها را تبدیل به شکارچیها و همینطور سگهای پلیس بهتری میکند.»به گفته «لینگژو لای»، یکی از محققان این پروژه، قدم بعدی ایجاد تغییراتی در ژن سگهاست که آنها را قادر به ابتلا به بیماریهای انسانی مربوط به ماهیچهها مثل پارکینسون کند. ایجاد سگهایی با بیماریهای انسانی به این دانشمندان اجازه میدهد که به درک بهتری از دلایل ایجاد این بیماریها و همچین درمان آنها برسند.
به گزارش ایندیپندنت، برای مهندسی کردن این سگها، محققان «پروتئین» مربوط به رشد (میوستاتین) را از بدن آنها حذف کردند.
مهار میوستاتین یک درمان جذاب برای دیستروفی عضلانی( muscular dystrophy) و سایر بیماریهای آمیوتروفیک است. یک پپتید متصل به میوستاتین با مجهز بودن به یک کاتالیزور اکسیژناسیون عکس روشن و خاموش فعال شد. این پپتید باعث اکسیژن رسانی انتخابی میوستاتین در زیر نور مادون قرمز نزدیک می شود که منجر به غیرفعال شدن میوستاتین می شود. این پپتید چندین مرتبه اثر مهاری بیشتر از پپتید اصلی نشان می دهد.
با مهار این ژن«میوستاتین»(Myostatin protein) به حجم ماهیچههای حیوانات به اندازه قابل توجهی افزوده میشود و آنها از حالت معمول قویتر میشوند.
دستآوردها و پیشرفتهای تازه علم ژنتیک به دانشمندان اجازه میدهد که به سادگی ژنهای جانداران مختلف را دستکاری کنند. این گروه از دانشمندان میگویند که این سگهای ماهیچهای در واقع سندی بر امکان ایجاد این تغییرات هستند و آنها امیدوارند که در آینده نزدیک تغییرات ژنتیکی بیشتری در این حیوانات بهوجود آورند.
از بین ۶۵ جنینی که دانشمندان روی آنها دستکاری ژنتیکی انجام دادند، ۲۷ توله سگ به دنیا آمدند که دوتا از آنها فاقد پروتئین «میوستاتین» هستند. این دو سگ را هرکول و تیانگو نام نهادهاند.
ژن رشد در سال ۱۹۹۷ توسط دانشمندان کشف شد و دستکاری آن در موشها باعث ایجاد موشهایی به نام «موشهای توانا» شده بود.
رادیوفردا درپایان نوشت:با آن که از نظر تئوری امکان این تغییر بدون دستکاری ژنتیک در انسانها هم وجود دارد، اما امکان آن بسیار کم است. به عنوان مثال، بیش از ده سال پیش پزشکان خبر از تولد نوزادی داده بودند که فاقد این پروتئین بوده و بسیار ماهیچهای و قوی بود.
کاربرد « کریسپر» در درمان بیماریهای خونی
بیماریهای خونی مانند کم خونی داسی شکل و تالاسمی بتا، بیماریهایی هستند که زندگی را تهدید میکنند و درمان شناختهشدهای به جز پیوند مغز استخوان از اهداکننده نزدیک ندارند. با وجود این، موفقیتهای اخیر نشان دادهاند که شاید با کمک فناوری کریسپر، افراد مبتلا به این بیماریها بالاخره بتوانند نفس راحتی بکشند و نهایتا امید به درمان وجود داشته باشد.
کمخونی داسیشکل
«کمخونی داسیشکل» با بروز تغییر در یکی از ژنهایی صورت میگیرد که هموگلوبین را کدگذاری میکنند. ویژگی این بیماری، شکلگیری سلولهایی است که شکل غیرطبیعی دارند و نشانههای آن، دردهای شدید، کمخونی، تورم اندامها، سکته و عفونتهای باکتریایی را شامل میشوند.
:max_bytes(150000):strip_icc():format(webp)/sickle-cells-GettyImages-685025589-23135c69d409497d8c723248185e206b.jpg)
گزینههای درمانی کنونی فقط نشانههای بیماری کمخونی داسیشکل را برطرف میکنند اما فناوری کریسپر، ظرفیت خود را در درمان علت ژنتیکی و زمینهای این بیماری نشان داده است. شرکت دارویی "ورتکس"(Vertex)، با یک روش جدید ژندرمانی موسوم به "CTX001" ، گام جدیدی برای تحقق این هدف برداشته است.
دادههای به دست آمده از بیماران طی آزمایشهای بالینی CTX001، نتایج امیدوارکنندهای را نشان دادهاند. "ویکتوریا گری"(Victoria Gray)، نخستین شخصی بود که برای درمان کمخونی داسیشکل با استفاده از این روش تحت درمان قرار گرفت و در ژوئیه ۲۰۲۰ اعلام شد که بیماری او بهبود قابل توجهی نشان داده است. سطح هموگلوبین او افزایش یافته و دردهای شدید او از بین رفته بود. مهمتر از همه اینکه او دیگر نیازی به تزریق خون نداشت. از آن زمان گزارش شده است که چندین بیمار دیگر مبتلا به کمخونی داسیشکل نیز بهبودی قابل توجهی نشان دادهاند.
اگرچه مداخله کریسپر برای درمان کمخونی داسیشکل در برخی از بیماران موفقیت آمیز بوده است اما افراد بسیاری هنوز در دریافت درمانهای ویرایش ژن برای این بیماری تردید دارند. ارزیابی ایمنی و کارآیی روش CTX001 در بیماران، کلید جلب اعتماد بیماران بیشتر است.
تالاسمی بتا
«تالاسمی بتا» مانند کمخونی داسیشکل، یک اختلال خونی است که به واسطه جهش در ژن کدگذاری کننده هموگلوبین ایجاد میشود. این بیماری معمولا در دوره نوزادی تشخیص داده میشود و نشانههای آن کمخونی شدید، ناهنجاریهای اسکلتی و رشد ضعیف هستند. دادههایی که اخیرا منتشر شدهاند، نشان میدهند که درمان با کمک کریسپر در حال حاضر به یک روش مهم برای درمان تالاسمی بتا تبدیل شده است.
پژوهشی که در سال ۲۰۲۰ در نشست سالانه "انجمن خونشناسی آمریکا"(ASH) ارائه شد، نشان داد روش CTX001، هفت بیمار مبتلا به تالاسمی بتا را به طور موثر درمان کرده است. این بیماران سطح هموگلوبین بالایی را نشان دادند، دیگر دچار درد شدید نشدند و مهمتر از همه اینکه دیگر نیازی به تزریق خون نداشتند.
با وجود نتایج امیدوارکنندهای که آزمایشهای انجام شده با روش CTX001 در درمان کمخونی داسیشکل و تالاسمی بتا نشان دادهاند، بررسی بیماران باید ادامه یابد تا اطمینان حاصل شود که این روش ویرایش ژن میتواند به اندازه کافی ایمن باشد.
کاربرد« کریسپر» در درمان بیماریهای نورودژنراتیو
«بیماریهای نورودژنراتیو»(Neurodegenerative diseases)، گروهی از بیماریهای لاعلاج و ناتوانکننده هستند که انحطاط پیشرونده ساختار و عملکرد سیستم عصبی مرکزی یا سیستم عصبی محیطی را به همراه دارند.
فناوری کریسپر اخیرا نه تنها برای نظارت بر داروهای این بیماریها بلکه برای ویرایش ژنهای خاص با هدف کمک به بیماران در بازیابی عملکردهای از دست رفته، خود را نشان داده است.
آلزایمر
آلزایمر، یک اختلال پیشرونده و کشنده مغزی است که حافظه و سایر فرآیندهای شناختی را به آرامی از بین میبرد. بیشتر افراد مبتلا به آلزایمر، بیش از ۶۵ سال دارند. هیچ درمانی برای این بیماری وجود ندارد و میزان مرگ و میر ناشی از آن، بیشتر از مرگ و میر ناشی از سرطانهای پستان و پروستات است.
اگرچه علتهای بسیاری برای بروز آلزایمر وجود دارد اما عوامل ژنتیکی بسیاری نیز وجود دارند که در آغاز این بیماری دخیل هستند. فناوری کریسپر، به عنوان روشی برای درمان این عوامل ژنتیکی در حال بررسی است.
«دکتر مارتین اینگلسون»(Martin Ingelsson)، پژوهشگر "دانشگاه اوپسالا"(Uppsala University)، نخستین کسی بود که از فناوری کریسپر برای مختل کردن یک ژن که در آغاز آلزایمر نقش دارد، استفاده کرد. این روش با موفقیت روی موشها انجام شد.
«دکتر سوبوجیت روی»(Subhojit Roy)، پژوهشگر "دانشگاه ویسکانسین- مدیسن"(UW–Madison)، رویکرد متفاوتی را در پیش گرفت. او از کریسپر برای تغییر دادن رمزگذاری ژن آغازکننده آلزایمر استفاده کرد تا یک پروتئین تغییریافته تولید شود.. در نتیجه این اصلاح، پروتئین دیگر نتوانست در پیشروی بیماری آلزایمر شرکت داشته باشد. دکتر روی نشان داد که این روش میتواند در موشها موثر عمل کند.
اگرچه این روشهای ویرایش با موفقیت انجام شدهاند اما اثر بلندمدت آنها بر آلزایمر هنوز مورد ارزیابی قرار نگرفته است. در حال حاضر، هیچ آزمایش بالینی برای این روش برنامهریزی نشده است.
بیماری هانتینگتون
«بیماری هانتینگتون»(Huntington's disease)، یک اختلال ژنتیکی کشنده است که به تجزیه پیشرونده سلولهای عصبی مغز منجر میشود و تواناییهای ذهنی و جسمی بیمار را از بین میبرد. این اختلال، در اثر جهش در ژن کدکننده پروتئین هانتینگتون شکل میگیرد. هیچ درمان شناختهشدهای برای بیماری هانتینگتون وجود ندارد و گزینههای درمانی کنونی نیز محدود هستند.
«دکتر شیائو جیانگ لی»(Xiao-Jiang Li)، پژوهشگر "دانشگاه اموری"(Emory University)، از کریسپر برای تخلیه پروتئین هانتینگتون استفاده کرد که توسط ژن جهش یافته بیان میشد. روش او نتایج موفقیتآمیزی را روی موشها نشان داد.
اگرچه پژوهشهایی از این دست، گام مهمی در جهت به کارگیری کریسپر در بررسیهای بالینی برای درمان بیماری هانتینگتون بودهاند اما عملکرد طبیعی هانتینگتون هنوز تا اندازه زیادی ناشناخته است. پیش از انجام دادن آزمایشهای بالینی باید اثرات بلندمدت این روش ارزیابی شود.
کاربرد « کریسپر» در درمان بیماریهای چشمی
بیماریهای ژنتیکی چشم تا چند سال گذشته، هیچ درمان شناختهشدهای نداشتند و علت اصلی نابینایی در دوره کودکی بودند. اخیرا در چندین پژوهش، از ویرایش ژن کریسپر برای اصلاح جهشهای عامل این بیماری استفاده شده و هدف آن بهبود بینایی بیماران است.
ورم رنگیزهای شبکیه
«ورم رنگیزهای شبکیه»(Retinitis Pigmentosa)، یک اختلال ژنتیکی است که تخریب و از بین رفتن سلولهای شبکیه را به همراه دارد. این بیماری اغلب وراثتی است و نشانههایی مانند مشکل دید در شب و از دست دادن بینایی محیطی را به همراه دارد. درمان شناختهشدهای برای این بیماری وجود ندارد و گزینههای درمانی آن محدود هستند.
«دکتر کانگ ژانگ»(Kang Zhang)، پژوهشگر "دانشگاه کالیفرنیا، سن دیگو"(UCSD)، از فناوری کریسپر برای درمان موشهای مبتلا به ورم رنگیزهای شبکیه استفاده کرد و توانست نتایج موفقیتآمیزی را به دست بیاورد. او توانست تعداد قابل توجهی از سلولهای میلهای را در دو مدل موش برنامهریزی کند و نتایج خوبی را مشاهده کرد.
«دکتر کین لیو»(Qin Liu)، پژوهشگر "دانشگاه هاروارد"(Harvard University) نیز یک روش مبتنی بر کریسپر را روی یک مدل خاص از موشهای مبتلا به ورم رنگیزهای شبکیه به کار گرفت و موفق شد تخریب سلولهای گیرنده نور را به تاخیر بیندازد.
لبر آموروزیس مادرزادی
«لبر آموروزیس مادرزادی»(Leber Congenital Amaurosis)، یکی از متداولترین دلایل نابینایی وراثتی است که در هر ۱۰۰ هزار نوزاد، دو تا سه مورد را تحت تاثیر قرار میدهد. این بیماری با جهش در گروهی از ژنها ایجاد میشود و بر سلولهای گیرنده نور در چشم اثر میگذارد. در حال حاضر، درمان شناختهشدهای برای این بیماری وجود ندارد و درمانهای ژنتیکی نیز هنوز در حال بررسی هستند.
شرکت زیستفناوری «ادیتاس مدیسین»(Editas Medicine)، طی یک آزمایش ویرایش ژن کریسپر موسوم به آزمایش "BRILLIANCE"، بررسی برای یافتن درمان لبر آموروزیس مادرزادی را در پیش گرفته است. این شرکت امیدوار است که در سالهای پیش رو بتواند پیشرفتهای چشمگیری را در زمینه به کارگیری فناوری کریسپر داشته باشد.
درمان با کمک فناوری کریسپر، به بیماریهایی که در این گزارش به آنها پرداختهایم، محدود نمیشود. دانشمندان از این فناوری برای درمان بیماریهای دیگری از جمله ایدز، دیابت و اوتیسم نیز استفاده کردهاند و نسبت به آینده این پژوهشها امیدوار هستند.
محدودیتهای فناوری کریسپر
«کریسپر» با وجود همه مزایایی که دارد، با محدودیتهایی نیز همراه است و بدون نقص نیست. بسیاری از دانشمندان هنوز برای به کار گرفتن این فناوری در درمان بیماران تردید دارند و نگران پیامدهای آن هستند.
یک مشکل بزرگ این است که کریسپر گاهی اوقات، DNA را در قسمتی به غیر از ژن مورد نظر قطع میکند؛ این موضوع با عنوان «ویرایش خارج از هدف» شناخته میشود. دانشمندان در مورد این مشکل نگران هستند و معتقدند که چنین ویرایشهای ناخواستهای میتواند مضر باشد و حتی به سرطانی شدن سلولها منجر شود. در هر حال، دانشمندان سعی دارند که توانایی کریسپر را در ایجاد برش مورد نظر بهبود ببخشند.
یکی دیگر از خطرات احتمالی، ورود اجزای کریسپر به سلولها است. ورود اجزای کریسپر به سلولهای پرورشیافته در آزمایشگاه یک مشکل است اما ورود آن به سلولهای بدن یک شخص، مشکل بسیار خطرناکی به شمار میرود. ورود اجزای کریسپر به سلولها میتواند آنها را آلوده کند و بروز بیماری را به همراه داشته باشد.
پژوهشگران در حال بررسی روشهای گوناگونی برای تنظیم دقیق به کارگیری کریسپر در اندامها یا سلولهای مورد نظر در بدن انسان هستند.
از آنجا که کریسپر قرار است به زودی به صورت گسترده در انسانها به کار گرفته شود، نگرانیهایی نیز در مورد نحوه واکنش سیستم ایمنی بدن نسبت به آن وجود دارد. برخی از دانشمندان احتمال میدهند که سیستم ایمنی بدن به این عامل بیگانه حمله کند و سلولهای ویرایش شده با فناوری کریسپر را از بین ببرد. با وجود این به نظر میرسد که روشهای جدید مبتنی بر «کریسپر» ایمنتر از روشهایی باشند که پیشتر مورد استفاده قرار گرفتهاند.
یک نگرانی دیگر این است که سلولهای ویرایش شده، تغییراتی را به صورت تصادفی در اسپرم یا تخمک پدید بیاورند و بر نسلهای آینده اثر بگذارند. در هر حال، دانشمندان سعی دارند که این فناوری را به صورت ایمن و بیخطر در انسانها به کار بگیرند.
بلندپروازی بشر در رسیدن به عمر طولانی موجب شد تکنیکهایی نوین ابداع کند تا با دست ورزیهای ژنتیکی علاوه بر تولید داروهای جدید، راه رسیدن به آرزوی دیرینه بشر هموار شود که این امر با تکنیک "کریسپر" فراهم شده است.
دنیایی را تصور کنید که در آن بیماری وجود ندارد و همه انسانها در برابر عوامل بیماریزا چون باکتریها و ویروسها مقاوم هستند و همه انسانها با مرگ طبیعی با دنیا وداع میکردند.
تصور کنید در دنیایی زندگی میکردیم که دیگر نیاز نبود با صرف هزینههای زیاد به داروها و واکسنهایی دست یابیم تا از انسان در برابر بیماریها حفاظت کنیم.
این همان دنیایی است که محققان با استفاده از اصلاح یا ویرایش ژنی به آن باور دارند و انتظار دارند که سالهای آینده به این چشم انداز برسند.
با این فناوری میشود انواع گیاهان، حیوانات و دیگر مواد غذایی مورد نظر انسان را مهندسی کرد. میتوان گوسفندانی تولید کرد که تا چندین برابر گوشت تولید کنند و یا میوههایی را به تولید رساند که در برابر آفتها مقاوم هستند و سطح عملکرد بالایی دارند.
این فناوری همچنین به کمک درمان بسیاری از بیماریها از جمله سرطان آمده و پزشکان امیدوارند در آیندهای نه چندان دور با این تکنیک روشهای درمانی برای بیماریهای لاعلاج ارائه دهند.
تکنیک «کریسپر» همچنین پزشکان را امیدوار کرده که با ویرایش ژنی، نوزادانی به دنیا بیاورند که در برابر بسیاری از بیماریها از جمله ایدز، مقاوم میشوند و طول عمر بیشتری را تجربه میکنند. به گفته دکتر فاضل از محققان حوزه زیست فناوری، کریسپر میتواند در تحقق این آرزوی دیرینه بشر جامه عمل بپوشاند.
بخش زیادی از داروها از میکروبها و باکتریها تولید میشود و بخش زیادی از داروها نیز بر پایه سلولهای موشی به تولید میرسند.
«رامین فاضل» مدیرعامل یکی از شرکتهای دانش بنیان تولید کننده کیتهای کووید-۱۹ در گفتوگو با ایسنا، گفت: دنیا به سمتی میرود که عمر جاودانه به انسانها ببخشد، به این معنا که هم مشکلات رفاهی آنها را مرتفع کند و هم طول عمر انسانها را افزایش دهد.
وی با بیان اینکه افزایش طول عمر یکی از آرزوهای انسان امروزی است، اظهار کرد: فناوری کریسپر در قالب مهندسی ژنتیک میتواند به بشر کمک کند، چرا که سر منشأ تحول و حرکت در حوزه زیست فناوری و بیوتکنولوژی، فناوری کریسپر بوده است.
«دکتر رامین فاضل» گفت: «کریسپر » فناوری ذیل مهندسی ژنتیک است، قطعا همان طور که بشر مسیر پیشرفت و توسعه را در پیش گرفته است، فناوریها و تکنیکهای جدیدی را عرضه میکند تا بتواند موجودات را دست ورزی ژنتیکی کند.
صفات مطلوب جایگزین نامطلوب
این محقق حوزه زیست فناوری(دکترفاضل) تاکید کرد: با استفاده از تکنیکهای مهندسی ژنتیک این امکان برای محققان فراهم میشود تا صفات نامطلوب، حذف و صفات مطلوب به آن اضافه شود و همچنین محصولاتی را با استفاده از ارگانیسمها و یا موجوداتی را تولید کنند که قبلا این توانمندی را نداشتند.
فاضل خاطر نشان کرد: بخش زیادی از داروها از میکروبها و باکتریها تولید میشود و بخش زیادی از داروها نیز بر پایه سلولهای موشی به تولید میرسند. به این معنا که داروهای انسانی توسط این ردههای سلولی تولید میشوند.
این محقق چنین دستاوردهای بشر را در راستای آرزوی دیرینه بشر برای افزایش طول عمر و رفاه دانست و افزود: تکنیک کریسپر ویژگیهایی دارد که امکان بیشتری را برای دست ورزی ژنتیکی برای انسان فراهم میکند و قطعا ما شاهد تحول و سرعت گرفتن تغییر و تحولات این حوزه و رسیدن به موجودات مطلوبی هستیم که شاخصها و فاکتورهای نامطلوب از آنها گرفته شده است.
«مدیر عامل شرکت دانش بنیان لیوژن» تاکید کرد: بر این اساس این امر دور از ذهن نخواهد بود که تا آینده نزدیک عملا "ابر انسان"ها (Supper Human) را ببینیم که همه اینها در این امر خلاصه شده که فناوریهایی چون کریسپر، هوش مصنوعی، پزشکی بازساختی و سلولهای بنیادی دست به دست هم میدهند تا آرزوهای بشر محقق شود.
وی با بیان اینکه روز به روز این فناوریها در حال تکمیلتر شدن و قویتر شدن هستند، اظهار کرد: برای توضیح بیشتر درباره تحولات این حوزه میتوان به تحولات فناوری IT اشاره کرد که روزی فلاپی دیسک در اختیار داشتیم که گنجایش ذخیره سازی آن محدود بود و بعد از آن هارد درایورها، USP ها و فلش مموری عرضه شد و در بایوتکنولوژی نیز شاهد چنین تحولاتی هستیم که روزی به سختی میتوانستیم تغییرات را اعمال کنیم.
فاضل ادامه داد: در برههای از زمان تغییرات حوزه زیست فناوری با هزینه و زمان بیشتر صورت میگرفت، ولی امروزه این تغییرات را با کیفیت بالایی اعمال میکنیم و تکنیک کریسپر نیز با ویژگیهایی که دارد، به راحتی میتواند ویرایشهای ژنتیکی را اعمال کند.
«مدیرعامل شرکت لیوژن فارمد» خاطر نشان کرد: به نظر میرسد که تا ۴ یا ۵ سال آینده اثرات این فناوری را میتوانیم در زندگی حس کنیم.
توضیح مدیریت سایت-پیراسته فر:«شرکت لیوژن» با نام «نانو فناوران دارویی نانو سینا» از سال ۸۴ شروع به کار کرد؛خدمات مختلف در حوزه زیست فناوری (یعنی ژن – سلول – پروتئین و ویروس) ارائه می دهد.
«شرکت لیوژن»در واقع یک شرکت دارویی در حوزه زیست فناوری - از سلولها برای تولید دارو استفاده می کند- مجموعه آزمونی(پکیج) را شامل بانکهای سلولی یا Cell Bank Characterization است./پایان توضیح مدیریت سایت.
امیدهای تازه برای رسیدن به بهترین نتایج
ایسنادرادامه نوشت:تکنیک کریسپر به دانشمندان این امکان را داده است که برای نخستینبار تغییرات دقیق را در DNA یا مولکول کشیدهای اعمال کنند که دربردارنده کد حیات برای بسیاری از موجودات زنده ازجمله انسان است.
بر این اساس محققان با استفاده از این فناوری منحصربهفرد، توانستهاند ژن بیماری ناشنوایی را در موشها حذف کنند و این دستاورد این امید را ایجاد کرده که شاید روزی راه درمانی برای ناشنوایی انسانها ارائه شود.
علاوه بر آن دانشمندان با استفاده از این روش، سلولهای «T» موشها را بهگونهای تغییر دادهاند که سلولهای سرطانی را با قدرت بیشتری، مورد حمله قرار دهند. همچنین طی مطالعاتی نشان دادهاند که با اصلاح ژنتیک، میتوان گونههای گیاهی جدیدی به وجود آورد که نسبت به خشکسالی و کمآبی، مقاومند.
این تحقیقات سالها است که در ایران آغاز شده که از آن جمله میتوان به طرح "ویرایش ژنوم در راستای تغییر رنگ گل با استفاده از تکنولوژی کریسپر" اشاره کرد. تغییر رنگ گل به دلیل اهمیت تجاری آن یکی از اهداف محققان است. با ایجاد تنوع در رنگ گلبرگ گیاهان زینتی میتوان درآمدزایی بالایی برای کشور ایجاد کرد و راه را برای صادرات آن به سایر نقاط دنیا هموار کرد. در گذشته به روش سنتی و مهندسی ژنتیک تلاشهایی در راستای تغییر رنگ صورت گرفته که با کندی همراه بود، ولی با کشف سیستم «کریسپر» امکان ایجاد تغییرات هدفمند در سطح ژنوم سرعت بیشتری به خود گرفت. برای ایجاد تغییر بوسیله کریسپر باید ژن مورد نظر و ناحیه هدف شناسایی شود که این کار بوسیله ابزار بیوانفورماتیک قابل انجام است.
تولید محصولات کشاورزی مقاوم به آفات و محصولاتی با ویژگیهای خاص همچون مقاوم به شوری و خشکی از دیگر دستاوردهای محققان با استفاده از تکنیک کریسپر است.
علاوه بر آن محققان پژوهشگاه ملی مهندسی ژنتیک و زیست فناوری با استفاده از فناوری جدید« کریسپر» موفق به تولید نخستین موش مدل هموفیلی در ایران شدند. در این طرح از روش ویرایش ژنوم کریسپر استفاده شده است؛ بدین ترتیب که ابتدا ژن فاکتور ۸ موشی مورد تجزیه و تحلیل قرار گرفت و منطقه مناسب برای هدفگیری انتخاب شد. در ادامه، RNA های راهنما سنتز و کلون شده و به پیش هسته جنین موش تزریق شدند، سپس جنینهای دستورزی شده به رحم موشهای مادرخوانده منتقل شدند و بعد از تولد نوزادان با آزمایشهای مولکولی و آنالیزهای بیوشیمیایی غیرفعال شدن این ژن در موشهای حاصل تایید شد.
این دستاورد برای مدلسازی بیماریها و بررسی داروها اهمیت زیادی دارد.
این دستاوردها در ایران و دنیا به گونهای است که به گفته متخصصان، این تکنیک هنوز در دنیا به مرحله درمان بالینی نرسیده، اما طی چند سال آینده این امر محقق خواهد شد و افرادی در کشور به بیماریهایی مبتلا هستند که میتوانند در آینده نزدیک به روش ویرایش ژنوم درمان شوند.
«دکتر مهدی توتونچی» عضو هیئت علمی و پژوهشگر دپارتمان ژنتیک پژوهشگاه رویان جهاد دانشگاهی در آستانه 20 اکتبر، روز جهانی کریسپر (World CRISPR Day) در گفتوگو با ایسنا، ضمن تشریح عملکرد فناوری کریسپر گفت: ویرایش ژنوم که ویرایش ژن نیز نامیده میشود، نوعی فناوری است که به دانشمندان توانایی تغییر دیانای (DNA) موجودات را میدهد. این فناوری اجازه میدهد تا مواد ژنتیکی در مکانهای خاصی از ژنوم اضافه، حذف یا تغییر کنند. چندین روش برای ویرایش ژنوم توسعه یافته است و سیستم اخیر CRISPR-Cas9 نامیده میشود. این سیستم نوعی تکنولوژی جدید ویرایش ژنتیکی است که میتواند به پیشرفت ژن درمانی کمکهای زیادی کند. تاکنون روشهای زیادی برای ژندرمانی کاندید شدهاند که از آن جمله میتوان به تکنیک «انتقال ژن» اشاره کرد؛ به این صورت که یک ویروس بیگزند، نسخه سالمی از یک ژن را به سلول انتقال میدهد تا جای یک ژن معیوب عامل بیماری را بگیرد؛ اما در روش کریسپر، دانشمندان میتوانند مستقیماً ژن معیوب را اصلاح کنند. آنها دیانای معیوب را جدا کرده و به جای آن یک دیانای سالم قرار میدهند.
عضو هیئت علمی و پژوهشگر دپارتمان ژنتیک پژوهشگاه رویان در تشریح عملکرد سیستم CRISPR-Cas9 افزود: این سیستم یک فناوری منحصر به فرد است که متخصصان ژنتیک و محققان پزشکی را قادر میسازد تا قسمتهایی از ژنوم را ویرایش کنند و این کار با حذف، افزودن یا تغییر بخشهایی از توالی دیانای صورت میگیرد. این روش در حال حاضر سادهترین، پرکاربردترین و دقیقترین روش دستکاری ژنتیکی است و بنابراین، باعث سر و صدا زیادی در دنیای علم زیست شناسی و پزشکی شده است.
«دکترمهدی توتونچی» خاطر نشان کرد: سیستم CRISPR-Cas9 از دو مولکول کلیدی Cas9 و gRNA تشکیل شده است که تغییر مورد نظر را در توالی دیانای ایجاد میکنند. آنزیم Cas9 به عنوان یک "قیچی مولکولی" عمل میکند که می تواند دو رشته دیانای را در یک مکان خاص در ژنوم برش دهد، به طوری که تکههای دیانای را میتوان اضافه یا حذف کرد. gRNA نیز یک قطعه آرانای (RNA) به نام آرانای راهنما است که شامل یک قطعه کوچک از توالی آرانای از پیش طراحیشده (حدود 20 باز) است که در یک داربست آرانای طولانیتر قرار دارد. قسمت داربست به دیانای متصل میشود و توالی از پیش طراحیشده، Cas9 را به قسمت مورد نظر در ژنوم هدایت میکند. این امر باعث میشود که آنزیم Cas9 در نقطه مناسب ژنوم برش ایجاد کند. در این مرحله سلول تشخیص میدهد که دیانای آسیب دیده است و سعی میکند آن را ترمیم کند. دانشمندان با استفاده از ویژگی دستگاه تعمیر دیانای تغییرات مورد نظر خود را با طراحیهای مولکولی ویژه اعمال میکنند.
تولید مدلهای بیماری در موجودات زنده با سیستم CRISPR-Cas9
عضو هیئت علمی دپارتمان ژنتیک پژوهشگاه رویان در تشریح کاربردهای سیستم CRISPR-Cas9 گفت: مهندسی ژنوم یک ابزار قدرتمند برای طیف وسیعی از کاربردها در تحقیقات زیست پزشکی است. سیستم CRISPR-Cas9 زمینه ویرایش ژنوم را متحول کرده است، بنابراین ویرایش ژنوم کارآمد را از طریق ایجاد شکستگیهای دو رشتهایِ هدفمند تقریباً در هر ارگانیسم و نوع سلولی تسهیل میکند. همچنین این سیستم برای اهداف دیگر، از جمله تنظیم بیان ژن درونزا، ویرایش اپیژنوم، ویرایش آرانای تک رشتهای و غربالگری ژن با توان بالا با موفقیت مورد استفاده قرار گرفته است.
«دکترمهدی توتونچی» تأکید کرد: با استفاده از سیستم CRISPR-Cas9 تولید مدلهای بیماری در موجودات زنده برای مطالعههای پیشبالینی امکانپذیر شده است. این سیستم بیشتر در ویرایش ژنوم سلولهای سوماتیک (غیرزایشی) مورد استفاده قرار میگیرد، اما علاقه زیادی در مورد پتانسیل این سیستم در ویرایش سلولهای زایشی (تولیدمثل) وجود دارد. از آنجا که هرگونه تغییری که در سلولهای زایشی ایجاد می شود، از نسلی به نسل دیگر منتقل میشود، پیامدهای اخلاقی مهمی را باید همواره در نظر گرفت. در حال حاضر انجام ویرایش ژنوم در سلولهای زایشی در اکثر کشورها غیرقانونی است. در مقابل، استفاده از سیستم CRISPR-Cas9 و سایر فناوریهای ویرایش ژنوم در سلولهای سوماتیک بحث برانگیز نیست.
وی خاطرنشان کرد: سیستم CRISPR-Cas9 دارای پتانسیل زیادی به عنوان ابزاری برای درمان طیف وسیعی از بیماریهای دارای مؤلفه ژنتیکی از جمله سرطان، هپاتیت B یا حتی کلسترول بالا است؛ همچنین میتوان از این سیستم در درمان بیماریهای عفونی، دیابت و اچآیوی بهره برد.
«عضو هیئت علمی دپارتمان ژنتیک پژوهشگاه رویان» درخصوص آینده سیستم CRISPR-Cas9 گفت: این سیستم میتواند برای آزمایش درمانهای جدید و کشف عملکرد آنها در سطح مولکولی مورد استفاده قرار گیرد. محققان درحال حاضر با ویرایش ژنهای خاص با استفاده از CRISPR-Cas9 در شرایط آزمایشگاهی، بیماری سرطان را به طور مؤثرتری مدلسازی میکنند و زیستتودهای در مقیاس بزرگ ارائه میدهند که به موجب آن میتوان مطالعههای عملکردی و دارویی را انجام داد.
«مهدی توتونچی» تصریح کرد: به احتمال زیاد سالها طول میکشد تا سیستم CRISPR-Cas9 به طور معمول در انسان مورد استفاده قرار گیرد. تحقیقات زیادی هم اکنون بر استفاده از آن در مدلهای حیوانی یا سلولهای جدا شده از انسان متمرکز هستند، با این هدف که در نهایت از این فناوری برای درمان معمول بیماریها در انسان استفاده شود.
عضو هیئت علمی دپارتمان ژنتیک پژوهشگاه رویان درپایان تأکید کرد: فناوری کریسپر به دلیل دقت بالا و هزینههای نسبتاً پایین تولید، میتواند همه چیز را در مورد ژنها، از درمان بیماریهایی مانند رفع اختلالات ژنتیکی، کم خونی داسیشکل یا هموفیلی گرفته تا بهبود کشاورزی تغییر دهد؛ پس میتواند دنیایی متفاوتتری را رقم بزند./منبع: سهشنبه ۲۷ مهر ۱۴۰۰« ایسنا»بااندکی اصلاحات وافزودن تصاویر.
کاشفان فناوری CRISPR .ازچپ. جنیفر دودنا ،امانوئل شارپانتیه و فنگ ژانگ.
منابع دیگر.ازسایتهای انگلیسی زبان.
«کریسپر» که مخفف «تناوبهای کوتاه پالیندروم فاصلهدار منظم خوشهای» است، به دانشمندان اجازه میدهد که DNA هر ژنوم را ویرایش کنند و خصوصیات یک ارگانیسم را بهطورکلی تغییر دهند.
ماحرایCRISPR/Cas در اواخر دهه 1980 و اوایل دهه 1990 آغاز شد که اکثر موجودات «پروکاریوتی»
از جمله بسیاری از باکتری ها و تقریباً همه باستان ها - ساختار عجیبی در
ژنوم خود دارند. بخشی از DNA آنها شامل بسیاری از توالیهای کوتاه کوتاه و
متمایز متمایز است که با دیگر توالیهای کوتاه و متغیر "فاصله" پراکنده شده
است.
زیست شناسان این ساختار را CRISPR نامیدند« پالیندرومیک خوشه ای منظم».
در مجاورت آن یک سیستم مرتبط با CRISPR (Cas) از ژنهای آنزیمهایی وجود دارد که می توانند DNA را قطع کنند. بعدها ، دانشمندان دریافتند که DNA در دنباله های فاصله با قطعات DNA ویروسی یکسان است.
«امانوئل شارپنتیر»(Emmanuelle Charpentier) از واحد Max Planck for the Science of Pathogens Institute for Infection Biology و Jennifer Doudna از دانشگاه کالیفرنیا ، برکلی به دلیل کار خود در زمینه ویرایش ژن CRISPR/Cas9 شناخته شده اند - تکنیکی که معمولاً به طور مختصر CRISPR نامیده می شود و اغلب به آن اشاره می شود. به عنوان «قیچی ژنتیک» این جایزه اولین بار است که به دو زن جایزه نوبل در علم اعطا می شود.
«امانوئل شارپانتیه» و «جنیفر دودنا»(Jennifer Doudna) نشان دادند که چگونه می توان بخش هایی از سیستم ایمنی باستانی موجود در باکتری ها«باکتریوفاژها»(genetic scissors)- را برای ویرایش DNA جایگزین کرد.
«امانوئل شارپانتیه» و «جنیفر دودنا» به عنوان کاشافان «قیچی ژنتیکی»(Genetic scissors)شناخته شده اند.
همکاری اصلی آنها در سال ۲۰۱۱ در نهایت جایزه نوبل شیمی را در سال ۲۰۲۰ برای آنها به ارمغان آورد. این یک برد تاریخی بود - دودنا و شارپانتیه اولین زنانی بودند که این جایزه را به اشتراک گذاشتند و این سطح جدیدی از آگاهی عمومی را برای زیست شناسی مصنوعی به ارمغان آورد.
دودنا و شارپانتیه اولین زنانی بودند که این جایزه را به اشتراک گذاشتند و این سطح جدیدی از آگاهی عمومی را برای زیست شناسی مصنوعی به ارمغان آورد.
این ترتیب باعث شد تیمی از محققان فرانسوی در سال ۲۰۰۵ پیشنهاد دهند که برای باکتری ها ، سیستم CRISPR/Cas ممکن است نوعی سیستم ایمنی برای مبارزه با مهاجمان ویروسی مداوم باشد. آنها پیشنهاد کردند که وقتی باکتری ها از یک عفونت ویروسی جان سالم به در بردند ، قطعات کوچکی از DNA ویروسی تمیز شده را در قسمت CRISPR ژنوم خود برای مرجع بعدی ذخیره کردند - مجموعه ای که محققان آن را "خاطره" تجاوزهای ژنتیکی "در گذشته توصیف کردند. ویروس دوباره به آن باکتری ها یا فرزندان آنها حمله کرد ، باکتری ها به نوعی می توانند از DNA ویروسی موجود در پرونده برای هدایت آنزیم های Cas به سمت مهاجمان برای از بین بردن سریع آنها استفاده کنند.
فناوری که «شارپانتیه و دودنا» توسعه دادند این قابلیت دقیق« برش ژنوم» را از باکتری ها وام گرفتند و آن را به یک ابزار «ویرایش ژنوم» کلی تر تبدیل کردند ، با ساختار ژنتیکی CRISPR به عنوان ابزار هدف و آنزیم Cas9 برای برش.
چگونه «امانوئل شارپانتیه» و «جنیفر دودنا» از CRISPR برای ویرایش ژن استفاده کردند؟
شارپانتیه
و دودنا با طرح ماشین آلات مولکولی دخیل در دفاع باکتریایی CRISPR/Cas9 در
برابر مهاجمان مکرر ویروسی شروع کردند. در اصل ، هنگامی که ویروس حمله می
کند ، باکتری های باقی مانده قطعه ای از DNA ویروس را در آرایه CRISPR خود
قرار می دهند. اگر آن ویروس دوباره به آنها یا فرزندان آنها حمله کند ،
باکتری قسمتی از CRISPR را که حاوی DNA ویروسی است به RNA رونویسی می کند.
مولکول RNA به همراه مولکول RNA دوم که قبلاً توسط «شارپانتیه» شناسایی شده بود ، پروتئین Cas9 را به سمت هدف هدایت می کند: DNA مربوط به ویروس در تلاش برای حمله مجدد. در آنجا ، مجموعه مولکولی نقش خود را به عنوان «قیچی ژنتیکی» ایفا می کند ، DNA ویروسی را قطع کرده و مهاجم را خلع سلاح می کند.
برای تبدیل این به یک ابزار «ویرایش ژن تعمیم یافته» ، «شارپانتیه و دودنا»
، به همراه دیگر همکاران ، دو نوع RNA را به یک "RNA راهنما" تبدیل کردند.
آنها نشان دادند که همراه با Cas9 ، این سیستم کارآمدتر می تواند DNA
ویروسی را در یک لوله آزمایش قرار دهد و برش دهد.
محققان از دهه 1970 قادر به استفاده از روشهای ویرایش ژن نوترکیب «برش و چسباندن»(cut
and paste) برای اصلاح سلولها بودند. اما این روشها ، که بر اساس آنزیمهای
باکتریایی طبیعی نیز ساخته شده بودند ، فاقد سطح دقیقی بودند که CRISPR می
تواند به آنها دست یابد. این تا حدی به این دلیل بود که چنین رویکردهای
نوترکیب اغلب نمی توانستند توالی های DNA منحصر به فرد را با دقت کافی هدف
قرار دهند: آنها ممکن است برش خود را در مکانی ناخواسته در امتداد ژنوم ،
با نتایج غیرقابل پیش بینی انجام دهند. می توان آنزیم ها را طوری طراحی کرد
که دنباله های طولانی تر و خاص تری را هدف قرار دهند ، اما این فرایند
بسیار سخت تر و پیچیده تر از CRISPR بود. سهولت استفاده به طور گسترده ای
به CRISPR در همه جا کمک کرد.
در سال 2018 ، محقق He Jiankui جهان را متحیر کرد وقتی گزارش داد که از CRISPR برای ویرایش ژنوم نوزادان دوقلو در تلاش برای مقاوم ساختن آنها در برابر HIV استفاده کرده است-بحث های طولانی مدت در مورد اخلاق ویرایش ژن ها دوباره آغاز شد. این اعلامیه بلافاصله با محکومیت گسترده جامعه علمی از جمله از سوی خود دودنا ، که این کار را وحشتناک ، خطرناک و زودرس خوانده بود ، دنبال شد. (دودنا در تشویق جامعه علمی بین المللی برای توسعه دستورالعمل های مناسب برای استفاده از CRISPR فعال بوده است.)
اما اخلاق ویرایش ژرمینال تنها نگرانی دانشمندان در مورد کاربردهای بالقوه CRISPR نیست. مورد دیگر نحوه استفاده از آن برای ایجاد آنچه به عنوان محرک ژن شناخته می شود را مورد بررسی قرار می دهد ، که به محققان اجازه می دهد شانس انتقال ویژگی مورد علاقه از والدین به فرزندان خود را به طرز چشمگیری افزایش دهند. در حالی که تا کنون این امر تنها در محیط های آزمایشگاهی انجام شده است ، برخی از دانشمندان امیدوارند روزی از آن برای کنترل گونه های مهاجم و حشرات حامل بیماری در طبیعت استفاده کنند. با این حال ، با توجه به تلاش های اخیر برای مدل سازی ، انجام این کار ممکن است با خطر نگران کننده ای از گسترش ژن به خارج از جمعیت هدف و خارج از کنترل همراه باشد.






























دانشمند(ژننتیک)چینی.PNG)