پیراسته فر
علمی،تحقیقی و تحلیلیپیراسته فر
علمی،تحقیقی و تحلیلیبازیگرهالیوود"الک بالدوین"فیلمبردارراکشت،کارگردان را هم زخمی کرد
«الک بالدوین» بازیگر باسابقه و سرشناس هالیوود، بااشتباه ،سر صحنه فیلمبرداری یک محصول وسترن،« هالینا هاچینز»(Halina Hutchins) مدیر فیلمبرداری راکُشت و «جوئل سوزا» کارگردانِ فیلم را زخمی کرد.
«جوئل سوزا» در بیمارستان در وضعیت وخیمی به سر می برد.
این حادثه روز پنجشنبه ۲۹ مهر۱۴۰۰ سر صحنه فیلمبرداری در حومه «سانتافه» در ایالت «نیومکزیکو» آمریکا اتفاق افتاد.
تولید پروژه فیلم سینمایی وسترن «راست»(Rust) ،تا اطلاع ثانوی متوقف شده است.
توضیح مدیریت سایت-پیراسته فر:دفتر کلانتر شهرستان سانتافه تایید می کند که دو نفر هنگام فیلمبرداری صحنه ای در صحنه فیلم وسترن رست بر اثر تیراندازی زخمی شدند. «هالینا هاچینز»، ۴۲، مدیر فیلمبرداری، و «جوئل سوزا» کارگردان، ۴۸ ساله، زخمی شدند.
«الک بالدوین» تهیه کننده و بازیگر ۶۸ ساله اسلحه ای را برای وسایل پرتاب شلیک کرد.
«الک بالدوین»،فکرمی کرد با فشنگ های خالی تیراندازی می کرد اما در لحظه اصابت، ترکش های گلوله دو نفر (هالینا هاچینز و جوئل سوزا)را پراکنده و مجروح کرد.
اپراتور با هلیکوپتر به کلینیک دانشگاه نیومکزیکو در آلبوکرکی منتقل شد. پزشکان نتوانستند جان«هالینا هاچینز» را نجات دهند.
اپراتور کشته شده، اهل روس است. او در اوکراین به دنیا آمد و در یک پایگاه نظامی شوروی در دایره قطب شمال بزرگ شد.
«الک بالدوین»(Alec Baldwin) بازی در مجموعه فیلمهای «ماموریت غیرممکن» را در کارنامه هنری خود دارد و برای درام رمانتیک «خنککننده» در سال ۲۰۰۴ موفق به کسب نامزدی جایزه اسکار در رشته بازیگری نقش مکمل شد.
وقوع حوادثی از این دست در هالیوود بیسابقه نیست. سال ۱۹۹۳ برندن لی، فرزند بروس لی، نیز در صحنه فیلمبرداری در پی شلیک اشتباهی جان باخت.
بازیگرهالیوود"الک بالدوین"فیلمبردارراکشت،کارگردان را هم زخمی کرد.
«الک بالدوین»بازیگر مشهور سینما دردرگیری برسرجای پارک بعلت مشت زدن به طرف مقابل بازداشت شد
الک بالدوین بازیگر مشهور سینما به دلیل مشت زدن به یک مرد بازداشت شد.
خبرگزاری مهر(۱۲ آبان ۱۳۹۷)نوشت:به گزارش به نقل از هالیوود ریپورتر، الک بالدوین بازیگر مشهور سینما به دلیل مشت زدن به یک مرد سر جای پارک بازداشت شد. این اتفاق ساعت ۲ بعد از ظهر روز جمعه ۲ نوامبر در جلوی خیابان دهم شرقی شهر نیویورک رخ داد.
سوفیا میسون از اداره پلیس نیویورک در این باره گفت: به نظر دعوا سر جای پارک بوده و شخصی که مشت وارد کرده اکنون در بازداشت به سر می برد. میسون همچنین تایید کرد که شخص مورد نظر بالدوین است و در ساختمان شماره ۶ مرکز پلیس بازداشت شده است.
نماینده شبکه ABC که برنامه ای از بالدوین از این شبکه در حال پخش است در بیانیه ای دراین باره گفت: «الک بالدوین شو» طبق برنامه روز یکشنبه ۴ نوامبر ساعت ۱۰ شب روی آنتن می رود.
شبکه NBC که بالدوین در برنامه «پخش زنده شنبه شب» این شبکه در نقش دونالد ترامپ بازی می کند از اظهارنظر در این باره خودداری کرده و وکیل شخصی بالدوین نیز تاکنون هیچ گونه واکنشی به این موضوع نشان نداده است.
البته این برای اولین بار نیست که بالدوین در مواجهه با قانون قرار می گیرد. او چندین بار پیش از این با پاپاراتزی ها درگیری داشته و بازداشت نیز شده است./پایان.
اقامه"نمازجمعه تهران"پس از ۲۰ ماه تعطیلی
اولین فردمبتلا درجهان در شهر« ووهان» کشور «چین» در۱۲دسامبر۲۰۱۹(پنج شنبه، ۲۱ آذر ۱۳۹۸)شناسایی شد.
برای اولین بار درایران بامرگ ۲نفردر قُم درچهارشنبه ۳۰بهمن۱۳۹۸ اعلام شدکرونامشاهده شده است.
آمار امروز کرونادر جهان : مبتلایان کرونا : ۲۴۳,۲۹۸,۷۵۰ نفر ، بهبود یافتگان : ۲۲۰,۴۹۰,۸۰۸ نفر ،فوت شدگان : ۴,۹۴۵,۹۴۰ نفر .
درایران:مجموع مبتلایان به کرونا : ۵,۸۳۳,۵۲۵ نفر ، مجموع فوت شدگان : ۱۲۴,۷۶۳ نفر
پس از ۲۰ ماه تعطیلی نماز جمعه، امروز ۳۰ مهر ۱۴۰۰(١٥ ربیع الاول ١٤٤٣)نماز جمعه تهران به امامت «حجتالاسلام محمدجواد حاجعلیاکبری»، برگزار شد.
ستاد نماز جمعه تهران : طی ۲۰ ماه گذشته، ۴ نوبت و هر بار در شرایطی که با فرود موج سرکش کرونا، مجالی برای اقامه مجدد نماز جمعه تهران فراهم میشده، اما رهبر معظم انقلاب اسلامی که همزمان، امامجمعه تهران نیز هستند، این موضوع را از ستاد ملی مقابله با کرونا استعلام و پیگیری میکردند که هر بار با طغیان موج جدیدی از این ویروس، فرصت ادای این فریضه الهی سلب میشد.
نکته مهم آنکه پس از موج اول کرونا، حداقل ۱۳۷ و حداکثر ۶۹۴ پایگاه در کشور اقامه نماز جمعه داشتند که این نسبت در موج دوم، از حداقل ۳۶۱ تا حداکثر ۶۴۴، در موج سوم از حداقل ۵۰ تا حداکثر ۸۰۰، در موج چهارم از حداقل ۵۴ تا حداکثر ۸۱۹ و در موج پنجم به دلیل صدور مجوز برپایی نمازجمعه مناطق قرمز، مشروط به اقامه در محیط باز و با تعداد نمازگزاران تعریف شده در پروتکل ابلاغی، از حداقل ۷۰۴ تا حداکثر ۸۶۹ متغیر بوده که تبعیت و همراهی قابل تحسین ائمه محترم و ستادهای نماز جمعه سراسر کشور را در راستای اجراییسازی مصوبات و شیوه نامههای بهداشتی به اذعان مسئولین و دستاندرکاران ستاد ملی مقابله با کرونا نشان میدهد.
در مراسم نماز جمعه این هفته تهران، سخنرانی پیش از خطبهها با «شیخ خالد ملا»، رئیس مجمع علمای اهل سنت از میهمانان کنفرانس وحدت بود.«نماز جمعه تهران»از اوایل تیرماه سال ۹۹ با نظر ستاد ملی مقابله با کرونا و تصمیم رهبر معظم انقلاب لغو شد.
گزارش نمازجمعه تهران امروز ۳۰ مهر ۱۴۰۰(١٥ ربیع الاول ١٤٤٣)
خبرگزاری مهرنوشت:خطیب موقت نماز جمعه تهران با اشاره به حوادث رخ داده در ۲۰ ماه گذشته در سطح منطقه و جهان گفت: در این ماهها مجموعهای از حوادث را در سطح منطقه و جهان شاهد بودیم که همه آنها نشان دهنده شکست آمریکاست. آمریکاییها در داخل با آن افتضاحاتی که در انتخابات ریاست جمهوریشان رخ داد شکست خوردند و بعد از انتخابات نیز این شکست ادامه پیدا کرد. در سطح منطقه و جهان نیز شکستهای آمریکا سرعت بیشتری به خود گرفت و ما هر روز شاهد شکست آنها هستیم.
وی ادامه داد: روند افول آمریکا با ترور شهید سلیمانی شروع شد و با عملیات نیروهای مسلح ایران در در هم کوبیدن عین الاسد و تصویب خروج نیروهای آمریکایی از عراق در مجلس این کشور ادامه پیدا کرد. آمریکاییها در توطئههای خود در لبنان و سوریه شکست خوردند و این روند ادامه دارد.
حاجعلیاکبری با اشاره به تحولات رخ داده در رژیم صهیونیستی گفت: رژیم صهیونیستی نیز در نبرد ۱۲ روزه سیف القدس شکست خورد و مقاومت مردم یمن نیز با عزت و اقتدار ادامه دارد و ان شاءالله در آیندهای نزدیک پیروزی آنها رقم خواهد خورد.
خطیب موقت نماز جمعه تهران با اشاره به اتفاقات رخ داده در ۲۰ ماه گذشته در کشورمان اظهار داشت: در داخل کشور نیز در ماههایی که گذشت تحولات بزرگی داشتیم. از سویی شاهد اقتدار نیروهای مسلح در دفاع از کشور و شکست توطئههای آمریکا و برگزاری رزمایشهای مختلف بودیم که آنها توانستند در برابر توطئههای آمریکا خوش بدرخشند همچنین شاهد شکل گیری یک مجلس انقلابی با یک رئیس جهادی هستیم.
حجتالاسلام حاجعلیاکبری ادامه داد: قوه قضائیه هم بعد از طی دو سال تحول با ریاست جدید روند تحولی خود را ادامه میدهد و خوشبختانه شاهد اتفاقات خوبی در این قوه هستیم.
وی با اشاره به انتخابات ریاست جمهوری در کشورمان گفت: تشکیل دولت خدمتگزار نیز اقدام بسیار خوبی بود که در ماههای گذشته اتفاق افتاده و در دو ماه گذشته دولت خدمتگزار موفقیتهای خوبی را در حوزههای مختلف مانند کنترل کرونا با گسترش واکسیناسیون و همچنین حضور در جمع مردم و جمعههای خدمت داشته است.
خطیب موقت نماز جمعه تهران شکست آمریکا در افغانستان را آخرین حلقه زنجیره شکستهای آمریکا در منطقه و جهان دانست و گفت: شاهد بودیم آمریکا بعد از ۲۰ سال چگونه از افغانستان فرار کرد. البته توطئههای استکبار جهانی به سرکردگی آمریکا ادامه دارد و این توطئهها را در شمال غرب ایران و حوادث اخیر در لبنان و انفجار در دو نماز جمعه شهرهای افغانستان مشاهده کردیم که جا دارد با ملت افغانستان همدردی کنیم و از مسئولان این کشور بخواهیم که حافظ جان مسلمانان باشند و عاملان این جنایتها را به سزای اعمال شأن برسانند.
وی تصریح کرد: همه اتفاقاتی که در حال رخ دادن است نشانه استیصال ابر جنایتکار زمان ما یعنی آمریکاست، آمریکاییها بعد از ۲۰ سال و هزینههای هنگفتی که برای ایجاد خاورمیانه جدید کردند و با ثبت بیش از ۸ هزار تریلیون دلار هزینه باید از منطقه بروند و به آنها میگوئیم اگر ۸۰۰ هزار تریلیون دلار هزینه کنید راهی ندارید و باید منطقه ما را ترک کنید.
رویکرد فسادستیزی دولت، قوه قضائیه و مجلس، امیدآفرین است
خطیب موقت نماز جمعه تهران با اشاره به حضور سران قوا در بین مردم گفت: جریان حضور مردمی رؤسای قوا بسیار پسندیده و موافق سیره نبوی و مورد تاکید مقام معظم رهبری است. این رفتار روحیه آفرین و دلگرم کننده برای مردم ماست.
حجت الاسلام حاج علی اکبری وجود فاصله با مردم با هر بهانهای را خواست شیاطین دانست و گفت: مردم باید مسئولین را از خود بدانند و حضور مسئولان در بین مردم و شنیدن مشکلات آنها بسیار پسندیده است.
وی گفت: فضای اداری ما نیاز به یک تحول در کارآمدسازی و مهربان سازی دارد. عزت مراجعه کنندگان باید در ادارات ما حفظ شود.
وحدت قوا شاخ غول، تورم و گرانی را میشکند
خطیب موقت نماز جمعه تهران رویکرد فسادستیزی که در دولت، قوه قضائیه و مجلس به وجود آمده است را بسیار امیدآفرین دانست و گفت: این رویکرد فسادستیزی نویدبخش تحقق اهداف انقلاب اسلامی است و امیدواریم این عیب و مشکلاتی که با بروز فساد در گوشه و کنار کشور ما به وجود آمده است از بین برود.
حجت الاسلام حاج علی اکبری نقش مجلس را در فسادستیزی بسیار مهم دانست و گفت: زنجیره فساد با اصلاح قانون توسط مجلس باید از بین برود و فرآیندها باید اصلاح شود و قوه قضائیه هم باید با رعایت کلیه موازین با مفسدان مبارزه کند و کمر مفسدین را بشکند و دستشان را قطع کند و منابع ملی نیز از حلقوم مفسدین بیرون کشیده شود.
وی با اشاره به اهمیت وحدت قوا گفت: وحدت قوا کار را پیش خواهد برد و در شکست شاخ غول بی شاخ و دم گرانی که مردم ما را دچار مشکلات فراوانی کرده است مؤثر خواهد بود. البته مردم ما صبور هستند و شرایط را به خوبی درک میکنند.
خطیبان جمعه ۶۰ هزار مشکل کشور را استخراج و به رئیس جمهور ارائه دادند
خطیب موقت نماز جمعه تهران در پایان با اشاره به اقدامات نهاد نماز جمعه در ۲۰ ماه گذشته گفت: با همکاری ائمه جماعت و خطیبان نماز جمعه بیش از ۶۰ هزار مساله کشور را استخراج کردهایم و در اختیار رئیس جمهور محترم قرار دادهایم. البته با استقبال ایشان نیز رو به رو شد. ما این مسائل را دنبال خواهیم کرد تا به نتیجه مطلوب برسیم.

سخنرران قبل ازخطبه

ایسنانوشت:دانشگاه تهران با رعایت پروتکل های بهداشتی مقابله با کرونا به روی نمازگزاران تهرانی باز شد.
تب سنجی از نمازگزاران در بدو ورود به دانشگاه و توزیع ماسک بین نمازگزاران از جمله تدابیر بهداشتی درنظر گرفته شده برای برگزاری این مراسم است.
وجود لیوان های یکبار مصرف و مایع دستشویی و ضدعفونی کننده در محل وضوی نمازگزاران از دیگر تدابیر بهداشتی اندیشیده شده جهت رعایت پروتکل های بهداشتی می باشد.
فاصله گذاری نسبتا مناسبی بین صفوف نماز و نمازگزاران در نظر گرفته شده و استفاده از ماسک در بین نمازگزاران مشهود است.
استقرار چندین دستگاه ماشین اورژانس در داخل دانشگاه و اتوبوس واکسیناسیون سیار اورژانس در خارج از دانشگاه از دیگر تدابیر بهداشتی در نظرگرفته شده برای برگزاری نمازجمعه این هفته تهران است.
استقرار موکب های پذیرایی و اجرای زنده سرود و تواشیح و ویژه برنامههایی برای کودکان و نوجوانان شرکتکننده، فضایی متفاوت را برای نمازگزاران از منظر استقبال و تکریم ایجاد کرده است.
سخنران پیش از خطبه های نمازجمعه «شیخ خالد ملا» رئیس مجمع علمای اهل سنت است و نماز جمعه نیز به امامت محمدجواد حاج علی اکبری اقامه میشود.
پس از استماع صحبت های سخنران پیش از خطبه های نمازجمعه، گروه قرآنی مدرسه دارالسلام به همخوانی قرآنی برای نمازگزاران پرداختند.
توضیح مدیریت سایت-پیراسته فر:آمار کرونادرجهان و ایران جمعه، ۳۰ مهر ۱۴۰۰
آمار سراسر جهان :مجموع مبتلایان : ۲۴۳,۲۹۸,۷۵۰ نفر
مجموع بهبود یافتگان : ۲۲۰,۴۹۰,۸۰۸ نفر
فوت شدگان : ۴,۹۴۵,۹۴۰ نفر
آمارکرونا درایران :
مجموع مبتلایان : ۵,۸۳۳,۵۲۵ نفر
مجموع بهبود یافتگان : ۵,۳۷۵,۴۷۵ نفر
مجموع فوت شدگان : ۱۲۴,۷۶۳ نفر
بنابر اعلام مرکز روابط عمومی و اطلاع رسانی وزارت بهداشت، از دیروزپنجشنبه( ۲۹ مهر ۱۴۰۰) تا امروزجمعه(۳۰ مهرماه ۱۴۰۰) و بر اساس معیارهای قطعی تشخیصی، ۱۱ هزار و ۶۴ بیمار جدید مبتلا به کووید۱۹ در کشور شناسایی شدند که ۱۴۷۷ نفر از آنان بستری شدند.
مجموع بیماران کووید۱۹ در کشور به ۵ میلیون و ۸۴۴ هزار و ۵۸۹ نفر رسید.
در طول ۲۴ ساعت گذشته، ۱۶۵ بیمار کووید۱۹ جان خود را از دست دادند و مجموع جان باختگان این بیماری به ۱۲۴ هزار و ۹۲۸ نفر رسید.
تا کنون ۵ میلیون و ۳۸۸ هزار و ۴۹۶ نفر از بیماران، بهبود یافته و یا از بیمارستانها ترخیص شده اند.
۴۴۲۲ نفر از بیماران مبتلا به کووید۱۹ در بخشهای مراقبتهای ویژه بیمارستانها تحت مراقبت قرار دارند.
تا کنون ۳۴ میلیون و ۵۵۱ هزار و ۲۰۶ آزمایش تشخیص کووید۱۹ در کشور انجام شده است.
در حال حاضر ۹ شهر کشور در وضعیت قرمز، ۱۰۶ شهر در وضعیت نارنجی، ۲۲۸ شهر در وضعیت زرد و ۱۰۵ شهر در وضعیت آبی قرار دارند.
همچنین تاکنون ۵۰ میلیون و ۳۷۳ هزار و ۴۸۸ نفر دُز اول واکسن کرونا و ۲۸ میلیون و ۲۹۱ هزار و ۷۷۷ نفر نیز دُز دوم را تزریق کرده اند و مجموع واکسنهای تزریق شده در کشور به ۷۸ میلیون و ۶۶۵ هزار و ۲۶۵ دُز رسید.
در شبانه روز گذشته، یک میلیون و ۲۳ هزار و ۹۱۵ دُز واکسن کرونا در کشور تزریق شد
اولین فردمبتلابه ویروس کرونا(کووید-۱۹) درجهان
اولین فردمبتلا درجهان در شهر« ووهان» کشور «چین» در۱۲دسامبر۲۰۱۹(پنج شنبه، ۲۱ آذر ۱۳۹۸)شناسایی شد.
در«ایران» ،برای اولین بار بامرگ ۲نفردر«قُم»روزچهارشنبه(۳۰بهمن۱۳۹۸)اعلام شد، بیماری کرونادرایران مشاهده شده است.
ووهان چین
عکس دختر"چاپوتووا"رئیس جمهوراسلواکی
اگر به خاطر شغل و جایگاه من نبود،« توماش ترابا» کاری به دخترم نداشت.
دعوای سیاسی در اسلواکی بر سر دختر رئیس جمهوری
انتشار تصویری از دختر«چاپوتووا» رئیس جمهوری اسلواکی توسط «توماش ترابا» نماینده پارلمان این کشور موجی از اعتراضات را در پیداشته است.
«توماش ترابا»، نماینده پوپولیست و مستقل پارلمان اسلواکی متهم است که با انتشار عکسی در فیسبوک به «اما چاپوتووا» دختر ۱۷ ساله رئیس جمهور این کشور که در یک شوی مد و لباس شرکت کرده بود، تاخته است.
زوزانا چاپوتووا در کنار دخترش
یورونیوز (۲۹ مهر ۱۴۰۰)نوشت:«زوزانا چاپوتوا» که اولین رئیس جمهوری زن در اسلواکی است در واکنش به انتشار این پست فیسبوکی نوشت: حمله به یک سیاستمدار به خاطر فرزندش حقیرانهترین شکل عمل سیاسی است. اگر به خاطر شغل و جایگاه من نبود،« توماش ترابا» کاری به دخترم نداشت.رئیس جمهور «زوزانا چاپوتوا»
رئیس جمهور اسلواکی در ادامه نوشت:«رذالت و حماقت انسان چیزهایی هستند که باید در زندگی با آنها روبه رو شوم و با آنها مبارزه کنم، اما فرزندانم سوای این موضوع هستند.»
چند تن از سیاستمداران اسلواکی حمایت خود را از رئیس جمهوری و خانواده وی اعلام کرده و پست آقای ترابا را محکوم کردهاند.
پلیس این کشور نیز اظهارات ترابا را «زورگویی سایبری» توصیف کرد. توماش ترابا اما این انتقادات و اتهام آزار و اذیت سایبری را رد کرد.
رذالت وحماقت
جنجال انتشار عکس دختر رئیس جمهوری از آنجا شروع شد که توماش ترابا پستی از شوی فشن لایو اسلواکی را در فیس بوک خود بازنشر کرد. در این شو دختر ۱۷ ساله رئیس جمهور هم به عنوان مدل ظاهر شده بود. ترابا با بازنشر کردن این پست نوشت:« از دیروز ما یک مدل برجسته و جدید در اسلواکی داریم.»
کاربران آنلاین معتقدند که این رفتار «آقای ترابا »تحقیرآمیز است و به خاطر حضورش در یک نمایش مد با دختر رئیس جمهوری رفتاری تحقیرآمیز شده است. انتقادات از رفتار این نماینده پارلمان آنقدر گسترده بود که فشن لایو آن را یک «حمله عمومی» توصیف کرد.
در یکی از پستهای انتقادی در شبکه اجتماعی اینستاگرام آمده است که ما رفتار ترابا در تحقیر دختر رئیس جمهور را محکوم میکنیم و از او میخواهیم که عذرخواهی کند. آقای ترابا اما میگوید که قربانی «قلدری» آنلاین شده است.
مزاحمت های سایبری
پلیس اسلواکی در بیانهای نوشته است که ترابا از حدود تخطی کرده است. در این بیانیه آمده است که :«یکی از مقامات عالی در دستگاه پلیس اسلواکی موضوع بدنام کردن یک دختر در انظار عمومی که حتی به سن ۱۸ سالگی هم نرسیده است را پیگیری خواهد کرد. فرقی نمیکند دختر چه کسی باشد، این حملهای است به یک کودک فقط به خاطر حضور عمومیاش.»
بیانیه پلیس میافزاید:« این یک نمونه از مزاحمتهای سایبری است. یک رفتار قرون وسطایی و از جمله مواردی است که پلیس با آن مبارزه میکند.»
پلیس اسلواکی اضافه کرده است که مزاحمتهای سایبری یک مشکل واقعی جهانی است که در دوران همه گیری کرونا، افزایش یافته است.
دفتر رئیس جمهوری اسلواکی از مردم خواسته است تا در پاسخ دادن و انتقاد از ترابا، از واژههایی که حاوی ابتذال و نفرت است پرهیز کنند.
توضیح مدیریت سایت-پیراسته فر:خانم «زوزانا چاپوتووا» درتاریخ ۱۱ فروردین ۱۳۹۸به عنوان نخستین رئیسجمهوری زن اسلواکی برنده انتخابات شد و درروز شنبه ۲۵ خرداد مراسم تحلیقش بود.
«زوزانا چاپوتووا» که با شعار مبارزه با فساد و بدون تجربه سیاسی وارد این انتخابات شده بود توانست رقیب قدرتمندش«ماروس سفیکوویچ» که از مقامهای ارشد اتحادیه اروپا هم هست را شکست دهد.
کریسپر"نوکلئاز"تلنز
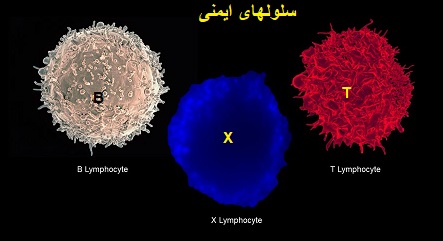
درادامه ....«سلولT» چیست؟ ...«سلول بنیادی خون ساز»کدامند؟،«نوکلئوتیدها» چیست؟
۳ نوکلئاز(nucleases) برای ویرایش ژنها : ZFN ها ، TALEN ها و CRISPR-Cas9
۱- ZFN«نوکلئاز انگشت روی» (Zinc Finger Nuclease)
۲- TALENs«نوکلئازهای فعال کننده شبیه رونویسی» (transcription activator-like effector nucleases)
۳- CRISPER «خوشه ای به طور منظم بین فواصل کوتاه تکرار پالیندرومیک»(Clustered Regularly Interspaced Short Palindromic Repeat )
این مورد ، دوران ویرایش ژنومی را متحول کرده است.
- اولین اندونوکلئازها نوکلئازهای انگشت روی (ZFNs) بودند. اینها بر اساس پروتئین های انگشت روی ، خانواده ای از عوامل رونویسی که به طور طبیعی وجود دارند ، بر روی اندونوکلئاز (Endonucleases)FokI1 ترکیب شده اند.
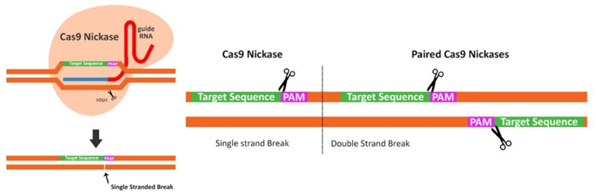
دامنه های انگشت روی می توانند توالی DNA تری نوکلئوتیدی را تشخیص دهند. بنابراین ، مجموعه ای از دامنه های انگشت روی مرتبط می توانند توالی های DNA طولانی تر را تشخیص داده و ویژگی مورد نظر را در مورد هدف ارائه دهند. با این حال ، نقوش انگشت روی روی یک آرایه بر ویژگی انگشتان روی همسایه تأثیر می گذارد و باعث می شود طراحی و انتخاب آرایه های انگشت روی اصلاح شده چالش برانگیزتر و وقت گیرتر باشد. پیش بینی ویژگی چیدمان نهایی دشوار است. اندونوکلئاز FokI به عنوان یک دیمر عمل می کند ، به این معنی که شکاف DNA دو رشته ای تنها در محل های اتصال دو ZFN به رشته های DNA مخالف رخ می دهد (شکل 1A).
این سیستم بر اساس دو ZFN طراحی شده است تا توالی های نوکلئوتیدی نزدیک یکدیگر را در محل مورد نظر تشخیص دهد و نیاز به تشخیص و اتصال همزمان هر دو ZFN دارد که طبیعتاً اثرات خارج از هدف را محدود می کند.
- نوکلئازهای فعال کننده شبیه رونویسی (TALENs) پروتئین های تلفیقی از پروتئین TALE باکتریایی و اندونوکلئاز FokI2 هستند.
مشابه ZFN ها ، ویژگی هدف از ارتباط پروتئین-DNA ناشی می شود. در مورد TALEN ها ، یک طرح TALE تنها یک نوکلئوتید را تشخیص می دهد و آرایه ای از TALEs می توانند با دنباله طولانی تری مرتبط شوند (شکل 1B).
فعالیت هر دامنه TALE فقط به یک نوکلئوتید محدود می شود و بر ویژگی اتصال TALEs همسایه تأثیر نمی گذارد و مهندسی TALEN ها را بسیار ساده تر از ZFNs می کند. به طور مشابه با ZFN ها ، نقوش TALE با اندونوکلئاز FokI مرتبط هستند ، که برای ایجاد شکاف نیاز به دیمیراسیون(dimerization) دارد. این بدان معنی است که اتصال دو TALEN مختلف در رشته های مخالف در مجاورت DNA مورد نیاز است.
* سیستم CRISPR-Cas9 (تکرارهای کوتاه کوتاه پالیندرومیک به صورت مرتب و خوشه ای) بر اساس سیستم ایمنی باکتری است.
این شامل نوکلئاز Cas9 و دو نوع RNA است: CRRNA فعال کننده فعال (tracrRNA) و یک RNA راهنمای واحد (sgRNA) که توالی هدف را با زوج استاندارد پایه واتسون-کریک تشخیص می دهد. پس از آن باید یک موتیف DNA به نام موتیف مجاور protospacer (PAM) دنبال شود.
هر پروتئین Cas9 دارای یک دنباله PAM خاص است ،
به عنوان مثال ، برای Cas9 استاندارد 5'-NGG-3 'است. برش DNA توسط نوکلاز Cas9 انجام می شود و در صورت استفاده از انواع آنزیمی وحشی به یک رشته دو رشته ای منجر می شود یا هنگام استفاده از انواع جهش یافته Cas9 به نام نیکاس منجر به شکست یک رشته می شود (شکل 1C).
تشخیص محل DNA در سیستم CRISPR-Cas9 توسط فعل و انفعالات RNA-DNA کنترل می شود. این مزایای زیادی نسبت به ZFN ها و TALEN ها دارد ، از جمله طراحی آسان برای اهداف ژنومی ، پیش بینی آسان در مورد سایتهای خارج از هدف و امکان تغییر چندین سایت ژنومی به طور همزمان
شکل 1. ویرایش نوکلئازها. A. ZFN - دو ZFN مجزا تشخیص داده و به مکانهای خاصی در رشته های DNA مخالف متصل می شوند. دایمر FokI مونتاژ شده به طور خاص DNA هدف را می شکند. B. TALEN ها - دو TALEN جدا از هم تشخیص می دهند و به مکانهای خاصی در رشته های DNA مخالف متصل می شوند.
دایمر FokI مونتاژ شده به طور خاص DNA هدف را می شکند. ج- در سیستم CRISPR-Cas9 ، محل DNA با تکمیل پایه بین DNA ژنومی و sgRNA ، مرتبط با tracrRNA ، تشخیص داده شده و در نوکلئاز Cas9 بارگذاری می شود ، که برش DNA را انجام می دهد.
ویژگی هدف ، مکانیسم عمل و طراحی آزمایشی برای ویرایشهای رایج مورد استفاده در نوکلئازها.جدول۱
کاهش اثرات خارج از هدف
طراحی ویرایش نوکلئازها به نحوی که اثرات خارج از هدف را کاهش دهد ، نه تنها برای رویکرد علوم پایه بلکه برای استفاده بالینی و صنعتی احتمالی آنها یک مسئله مهم بود.
تحویل ZFN ها و TALEN ها ، چه در شرایط in vivo و چه in vitro ، می تواند به دلیل اتصال در مکان های خارج از هدف و ایجاد شکاف DNA ناخواسته منجر به مسمومیت یا کشندگی شود.
جهش در FokI در مورد ZFN ها و TALEN ها برای ترویج فعالیت اندونوکلئاز FokI تنها در طول رویدادهای هترو دیمریزه شدن در مکانهایی که توسط دو نوکلئاز گسسته محدود شده اند معرفی شد.
برش خارج از هدف سیستم های CRISPR-Cas9 عمدتاً از تشخیص سایتهای ژنومی کاملاً یا تا حدی مکمل توسط sgRNAs8 ناشی می شود. روشهای مختلفی برای محدود کردن برش خارج از هدف پیشنهاد شده است ، از جمله محدود کردن مقدار و زمان پروتئین فعال Cas۹ در سلولها با روشهای تحویل انتخابی یا تغییر نیمه وقت Cas9۹.
تعدادی از انواع Cas۹ با ویژگی خارج از هدف توسعه یافته است ، از جمله HF-Cas9 ، eCas۹ و HypaCas910–12. انواع جدید همولوگهای Cas۹ و Cas9 ، مانند CRISPR-Cas12 (Cpf1) و CRISPR-Cas13a (C2c2) ، می توانند PAM های مختلف را تشخیص دهند ، نه تنها به طور قابل ملاحظه ای گزینه های ویرایش ژنوم دقیق را افزایش می دهند ، بلکه به طور بالقوه دارای ویژگی خاص در هدف هستند.
یک جایگزین جالب یک ترکیب Cas۹ با Noklease FokI است که مزایای ZFNs/TALENs و سیستم CRISPR-Cas9 را ترکیب می کند.
کیمرهای Cas۹ به عنوان ابزارهای تحقیقاتی جدید - نه تنها برای برش DNA
کیمرهای مختلف Cas۹ ، از جمله مطالعات مربوط به کاهش عملکرد و افزایش عملکرد ، به تازگی توسعه یافته اند.
وجود Cas9 امکان هدف گیری ژنومی را فراهم می کند ، در حالی که پروتئین های اضافی دیگر می توانند فعالیت Cas9 را تعدیل کنند.
در "تداخل CRISPR" (CRISPRi) ، همجوشی پروتئین Cas۹ با یک حوزه تأثیرگذار سرکوبگر KRAB امکان تنظیم بیان ژن را با سرکوب رونویسی فراهم می کند. این روش مزیتی نسبت به تکنیک های استاندارد تداخل RNA (RNAi) ایجاد می کند و امکان بررسی عملکرد ژن های کد کننده غیر پروتئینی را فراهم می کند. علاوه بر این ، روش مخالف (فعالسازی CRISPR ، CRISPRa) امکان پذیر است. ادغام Cas9 با دامنه های فعال سازی رونویسی (به عنوان مثال ، VP64) منجر به افزایش بیان مکان های ژنومی مورد نظر می شود. فعال سازی اضافی رونویسی را می توان با واسطه فعال سازی هم افزایی (SAM) به دست آورد ، جایی که تلفیق Cas۹ شامل چندین حوزه فعال سازی برای به حداکثر رساندن کارایی فعال سازی است.
برخی از کیمرهای Cas۹ فعالیت نوکلئاز ندارند. به عنوان مثال ، ترکیبات Cas9 با آنزیمهای اصلاح کننده کروماتین در مطالعات اپی ژنوم برای تجسم مکانهای اتصال پروتئین به DNA ، برای بررسی ساختار کروماتین یا برای تحقیقات اصلاح هیستونها پس از ترجمه استفاده می شود
CRISPR-Cas9 و نوآوری های ویرایش ژن خط سلولی
از CRISPR-Cas9 می توان برای معکوس کردن جهش های ژنتیکی مضر در ژنوم انسان استفاده کرد. این رویکرد به پروتئین Cas9 ، tracrRNA و sgRNA مخصوص سایت همراه با قالب DNA ترمیمی حاوی توالی نوع وحشی نیاز دارد. Cas9 یک شکست DNA مخصوص سایت ایجاد می کند که متعاقباً توسط ماشین های تعمیر DNA میزبان ترمیم می شود و آلل های نوع وحشی را بازیابی می کند (شکل 2A).
CRISPR-Cas9 همچنین می تواند به عنوان یک ابزار قابل اعتماد در مهندسی خط سلولی عمل کند. این رویکرد مستلزم تحویل پروتئین Cas9 ، tracrRNA و sgRNA مخصوص سایت است. Cas۹ یک شکست DNA مخصوص سایت ایجاد می کند که توسط دستگاه تعمیر DNA میزبان ترمیم می شود. در غیاب الگوی تعمیر ، می تواند منجر به کوتاه شدن جهش های پوچ شود. یک روش هدفمندتر با معرفی الگوهای تعمیر حاوی جهش مورد نظر در دسترس است (شکل 2B)
راه های آینده
ویرایش نوکلئازها مهندسی ژنوم را متحول کرده و امکان ویرایش آسان ژنوم پستانداران را فراهم کرده است. آنها معمولاً نه تنها در تحقیقات اساسی بلکه در مطالعات پیش بالینی و بالینی نیز به عنوان مکانیسم بالقوه برای معکوس کردن جهش های ایجاد کننده بیماری های مبتنی بر DNA در بیماریهای ژنتیکی ارثی استفاده می شوند. نوآوری های غیرتجاری و تجاری اجازه توسعه مداوم فناوری هایی را داده اند که تنها ۲۰ سال پیش آغاز شده اند و در آینده حتی بیشتر در پیشرفت علم و زیست پزشکی استفاده خواهند شد.
توضیح مدیریت سایت-پیراسته فر:منبع این مقاله :یک سایت انگلیسی زبان درباره عملکردکریسپر/۱۰ مهر ۱۳۹۷
ومقاله بعدی ازمنابع دیگر
کاربرد بالینی درمانهای سلولی ویرایش شده با ژن ex vivo اولین بار با ویرایش «نوکلئاز انگشت روی»(zinc finger nuclease) روی سلولهای T+ CD4+ اتولوگ آغاز شد. ویرایش با هدف ایجاد اختلال در بیان ژن CCR5 گیرنده ویروس نقص ایمنی انسانی ، با هدف ایجاد سلولهای مقاوم در برابر ورود ویروس ، قبل از تزریق مجدد به بیمار انجام شد. از آن زمان به بعد با ورود فن آوری های ویرایش جدید نوکلئازهای فعال کننده رونویسی (TALENs) و تکرارهای کوتاه کوتاه(palindromic) پالیندرومیک (CRISPR) و مزایای بالقوه ویرایش ژن در عرصه های ایمونوآنکولوژی و اختلالات خونی به سرعت تشخیص داده شد. از آنجا که گستردگی درمان های سلولی موجود از نظر بالینی همچنان در حال افزایش است ، علاقه روزافزون به رویکردهای آلوژنیک و خارج از قفسه و استراتژی های ویرایش چندگانه به طور فزاینده ای مورد استفاده قرار می گیرد. ما در اینجا آخرین آزمایشات بالینی با استفاده از این فناوری های ویرایش را مرور می کنیم و برنامه های کاربردی را در نظر می گیریم.
زمینه
سلول درمانی به عنوان تجویز سلول های زنده به بیمار با هدف ترمیم یا جایگزینی سلول ها یا بافت های آسیب دیده تعریف می شود. این بیماری به جمعیت سلولی از پیش تعیین شده ای وابسته است که می تواند از یک بیمار (اتولوگ) یا از یک اهدا کننده متفاوت (آلوژنیک) باشد. نوع سلول درمانی با آزمایشات بالینی که در حال حاضر تحت سلطه سلول های خون ساز ، سلول های پیام رسان «مزانشیمی » و «لنفوسیت ها »قرار دارد ، بسیار متفاوت است.
سلول های اپی تلیال تیموس(TEC)
اما با فرکانس پایین تر ، «سلولهای دندریتیک» ، «سلولهای کبدی» ، سلولهای «اپیتلیال» و انواع دیگر در حال بررسی است . از نظر بیماری ،« انکولوژی»(تشخیص سرطان) مسئول بیش از نیمی از آزمایشات سلول درمانی است . نکته قابل توجه این است که عرصه نوظهور درمان های سلولی با تأییدیه های متعددی در سال های اخیر تقویت شده است . برخلاف سایر درمان ها ، سلول درمانی ها محصولات سلولی زنده هستند و با استفاده از مهندسی ژنتیک می توان آنها را برای دستیابی به اثربخشی بهتر و یا متناسب با تک تک بیماران افزایش داد. نکته مهم این است که آنها برای نشان دادن ایمنی و سازگاری به ویژگی های گسترده ای نیاز دارند. در این زمینه قابل توجه است که توزیع in vivo ، بقا و اثر بخشی آنها در هدف ، بلکه بافتهای خارج از هدف پارامترهای حیاتی هستند. به عنوان مثال ، فعالیتهای خارج از هدف منجر به عوارض جانبی شدید شد ، در حالی که سایر عوارض جانبی و مرگ و میر در طول آزمایشات بالینی نیز گزارش شده است. این امر همراه با این واقعیت که بیشتر آزمایشات بالینی سلول درمانی هنوز بدون اطلاع از توزیع in vivo و سرنوشت سلول های درمانی تجویز شده انجام می شود ، منجر به پیشنهاداتی برای پیگیری معمول ردیابی سلول های درون بدن (با تصویربرداری) شد و ژنهای خودکشی .
در اعضا «لنفاوی ثانویه»، «لنفوسیت های B» با سلول های دندریتی فولیکولی پراکنده واکنش نشان می دهند.این سلول ها دارای زوائد فیلامانی بلندی هستند و برخلاف دیگر سلول های دندریتی، دارای منشا مزانشیمی می باشند و عمکرد ان ها وابسته به مولکول های MHC کلاس 2 نیست. سطح این سلول ها توسط کمپلکس آنتی ژن_ آنتی بادی پوشیده شده که به پروتئین های کمپلمان و نواحی Fc ایمونوگلوبولین وصل شده و د رنهایت به سلول های B متصل می شوند و آن ها را فعال می نمایند. نتیجه این اعمال ایجاد گره های لنفاوی کوچک اولیه است. با کمک و همراهی لنفوسیت های T در مجاورت این ساختمان ها ، سلول های B به تدریج گروه های بزرگتری به نام «گره های لنفاوی ثانویه» را ایجاد می نمایند.
«پروتوانکوژنها »،ژنهایی هستند که برخی از آنها فاکتورهای رشد سلول، برخی دیگر، «رسپتورهای» فاکتورهای رشد، دستهای از آنها اجزاء سیستم انتقال پیام داخل سیتوپلاسم، عدهای فاکتورهای رونویسی و برخی از آنها فاکتورهای کنترل کننده سیکل سلولی را کد میکنند.
برخی از ویروسها دارای ژنهایی مشابه «انکوژنهای سلولی» میباشند که در صورتیکه این ویروسها وارد سلولهای عادی شوندموجب سرطانی می شوند،به عبارتی،«انکوپروتئینها» باعث سرطانی شدن سلولها میشوند.
« انکوپروتئین»،محصول پروتوانکوژنها هستند.
انکوژنها(ژنهای تومورزا) ژنهای تغییر یافتهای هستند که در حالت عادی پروتئینهایی را، که در کنترل رشد و تکثیر سلولها نقش دارند، بیان میکنند. این ژنها در حالت عادی «پروتوانکوژن» نامیده میشوند.
ولی در صورت بروز جهش در پروتوانکوژنها، آنها به انکوژنها تبدیل میشوند. انکوژنها باعث بروز سرطان میشوند.
جهشهایی که پروتوانکوژنها را به انکوژنها تبدیل میکنند، اغلب باعث بیان بیش از حد فاکتورهای کنترلی، افزایش تعداد ژنهای کد کننده آنها و یا تغییر فاکتورهای کنترلی بصورتیکه فعالیت فاکتورها، افزایش یابد و یا نیمه عمر آنها در سلول زیاد شود، میگردد.
ابتدا انکوژنها در ویروسها کشف شدند که انکوژنهای ویروسی نامیده میشوند.
به واسطه جهش در پروموتر پروتوانکوژنها آنها به انکوژنها فعال تبدیل شده و بیان آنها زیاد شده، تکثیر سلولها افزایش یافته و تومور ایجاد میشود.
از آنجا که اثربخشی و تطبیق بهتر با بیماران به طور فزاینده ای از طریق مهندسی ژنتیک به دست می آید ، جنبه های مربوط به ایمنی اخیر می تواند در این مرحله به سلولهای درمانی تبدیل شود. به طور سنتی ، مهندسی ژنتیک با استفاده از بردارهای ویروسی (به عنوان مثال γ-retroviruses ، lentiviruses) ، که ترانس ژن ها را کم و بیش به طور تصادفی در ژنوم ادغام می کند ، به دست آمده است .پ این رویکرد اغلب به عنوان "ژن درمانی" نیز طبقه بندی می شود و در درمان های سلولی در علل مختلف استفاده می شود ، به عنوان مثال ، از ایمونوتراپی سرطان تا تنظیم تحمل ایمنی در بیماریهای خود ایمنی.
شکل خاصی از« مهندسی ژنتیک ویرایش ژن »است که روش بسیار بیشتری را برای ادغام بار ژنتیکی مطلوب در مکانی مشخص در ژنوم سلولهای هدف ارائه می دهد .
از آنجا که وسعت درمانهای سلولی موجود از نظر بالینی همچنان در حال افزایش است و روشهای ویرایش ژن فرصتهای بالقوه ای را برای تغییر بازی فراهم می کند ، ما در اینجا آخرین آزمایشات بالینی را با استفاده از این فناوری جدید مرور می کنیم.
راه باریک و پیچ در پی درمان سلول های مهندسی ژنتیک
در حالی که استراتژی های مهندسی ژنتیک به طور کلی درمان های سلولی را به نفع بیماران افزایش داده است ، این سفر هموار نبوده است. اولین گزارش مهندسی سلول درمانی موفق در بیماران مبتلا به نقص سیستم ایمنی شدید (SCID-X1) مرتبط با X و شامل جمع آوری CD34+ hSC های بیمار ، انتقال آنها به صورت in vivo با یک رتروویروس γC Moloney با کمبود تکرار حاوی ژن زیر واحد مشترک گیرنده cC ، بود. یک ژن مرتبط با کروموزوم X که در بیماران SCID-X1 غیر فعال می شود و آنها را عاری از سلولهای T بالغ و قاتل طبیعی (NK) می کند .
هدف از این روش بازگرداندن ظرفیت بیمار برای تشکیل سلولهای T و NK بالغ بود. hSC های مهندسی شده مجدداً به بیماران
بردارهای ویروسی هم بیان ژن قوی و هم کارآیی بالای مهندسی و همچنین علت را امکان پذیر کرده بودند
راه باریک و پیچ در پی درمان سلول های مهندسی ژنتیک
در حالی که استراتژی های مهندسی ژنتیک به طور کلی درمان های سلولی را به نفع بیماران افزایش داده است ، این سفر هموار نبوده است. اولین گزارش مهندسی سلول درمانی موفق در بیماران مبتلا به نقص سیستم ایمنی شدید (SCID-X1) مرتبط با X و شامل جمع آوری CD34+ hSC های بیمار ، انتقال آنها به صورت in vivo با یک رتروویروس γC Moloney با کمبود تکرار حاوی ژن زیر واحد مشترک گیرنده cC ، بود. یک ژن مرتبط با کروموزوم X که در بیماران SCID-X1 غیر فعال می شود و آنها را عاری از سلولهای T بالغ و قاتل طبیعی (NK) می کند .
هدف از این روش بازگرداندن ظرفیت بیمار برای تشکیل سلولهای T و NK بالغ بود. hSC های مهندسی شده مجدداً به بیماران تزریق شد و طی ۱۰ ماه نتایج مثبت مشاهده شد ، در حالی که محفظه های T و NK بیمار توسط سلولهای بیان کننده ژن γC پر شده بود. متأسفانه ، نزدیک به ۳ سال پس از تزریق ، دو بیمار در نتیجه گسترش کلونی سلولهای T مهندسی شده دچار سرطان خون شدند. هر دو بیمار تزریق «پروویرال»(ماسترولون) داشتند که منجر به فعال شدن «پروتوآنکوژن» LMO2 و تکثیر تصاعدی این سلول ها شد.(انکوژن شکل جهش یافته)
بردارهای ویروسی هم بیان ژن قوی و هم کارآیی بالای مهندسی را امکان پذیر کرده بودند ، اما باعث بیماری پایین دست نیز شده و بدین ترتیب روشن شد که درک بهتری از خطرات بلندمدت مهندسی ژنتیک مورد نیاز است. در سالهای پس از این مطالعه ، تعداد زیادی بردار جدید برای کاهش پتانسیل ایجاد جهش زایی درونی و افزایش ایمنی طراحی شد ، اما برخی در این زمینه در حال حاضر به دنبال استراتژی دقیق تری برای معرفی تراریخته در مکان های مشخص شده در ژنوم بودند.
توسعه روشهای مهندسی ژنتیک ویژه سایت
پس از کشف اینکه شکستگی های دو رشته ای DNA (DSB) می تواند باعث ترمیم شود ، دانشمندان به دنبال بهره برداری از فرایند ترمیم به منظور دستکاری سلول ها با دقت یک جفت پایه بودند. نوکلئازهای متمایز با ظرفیت تشخیص توالی های DNA مورد علاقه (محل های تشخیص) در ژن های درون زای پستانداران مهندسی شد ، که همچنین می تواند DNA را در این مکان ها برش دهد. محققان اصول« اندونوکلئازهای» خانگی را که برای اولین بار در مخمر جوانه زده کشف شد ، دنبال می کردند و پایه های آنچه به عنوان «ویرایش ژن» معروف شد را پایه گذاری کردند. این رویکردهای ویرایش هدفمند در حال حاضر به طور گسترده ای در تحقیقات بالینی و بالینی مورد استفاده قرار می گیرد.
«نوکلئازهای انگشت روی» (ZFNs) اولین نوکلئازهای طراح بودند که از خانواده فاکتورهای رونویسی طبیعی شناخته شده به نام پروتئین انگشت روی تولید شدند و با اندونوکلئاز FokI ترکیب شده اند. پروتئین های انگشت روی به عنوان حوزه های متصل به DNA عمل می کنند که دنباله های DNA «تری نوکلئوتیدی »را تشخیص می دهد ، و پروتئین هایی که به صورت سری به هم پیوند خورده اند امکان شناسایی توالی های DNA طولانی تر را فراهم می کنند و در نتیجه ویژگی تشخیص توالی را ایجاد می کنند. FokI ذوب شده به عنوان یک دیمر عمل می کند.
بنابراین ZFN ها برای تشخیص توالی »نوکلئوتیدها» در مجاورت یکدیگر جفت می شوند (شکل 1a). این اطمینان می دهد که DSB ها تنها زمانی تولید می شوند که دو ZFN همزمان به رشته های متضاد DNA متصل شوند ، به این ترتیب ویژگی تشخیص توالی با طول دامنه های متصل شده به DNA تعیین می شود. این امر اثرات خارج از هدف را محدود می کند ، اما با جنبه منفی آن آرایه های نقوش انگشت روی روی ویژگی انگشت روی روی همسایه تأثیر می گذارد و طراحی و انتخاب آنها را چالش برانگیز می کند.
مطالعات اولیه بر تحویل کاست بیان ZFN به سلولها از طریق قطعات DNA مشتق شده از ناقلهای ویروسی متکی بود.
مطالعات بعدی با استفاده از انتقال mRNA از طریق «الکتروپوراسیون» برای ورود به سلولهای هدف پیشرفت کرد. این رویکرد سطوح گذرا اما بالایی از کاست بیان را در داخل سلول ها ارائه می دهد و خطر کمتری برای درج/جهش زایی در مکان های خارج از هدف در نتیجه نیمه عمر کوتاه تر mRNA در مقایسه با DNA ارائه می دهد.
این مشخصات ایمنی بهبودیافته با مزایای انتقال بسیار کارآمد (با سطوح> 90 reported گزارش شده) و ماندگاری عالی سلول
«فناوریهای ویرایش ژن »مورد استفاده در سلول درمانی سه ساختار اساسی و ویژگی های اصلی هر پلت فرم ویرایش که به طور بالینی در درمان های سلولی مورد استفاده قرار می گیرد نشان داده شده است که نحوه تعامل ویرایشگر با DNA را به منظور شروع شکست دو رشته نشان می دهد.
«نوکلئازهای انگشت روی» (ZFNs) شامل پروتئین های انگشت روی هستند که مستقیماً به اندونوکلئازهایی مانند FokI متصل شده اند. پروتئین های انگشت روی به عنوان حوزه های متصل به DNA عمل می کنند که دنباله های DNA تری نوکلئوتیدی را تشخیص می دهد ، و پروتئین هایی که به صورت سری به هم پیوند خورده اند امکان شناسایی توالی های DNA طولانی تر را فراهم می کنند و در نتیجه ویژگی تشخیص توالی را ایجاد می کنند.
FokI ذوب شده به عنوان یک دیمر عمل می کند ، بنابراین ZFN ها برای تشخیص توالی های نوکلئوتیدی در مجاورت یکدیگر مهندسی می شوند و اطمینان حاصل می شود که DSB ها تنها زمانی تولید می شوند که دو ZFN همزمان به رشته های مخالف DNA متصل شوند. b نوکلئازهای فعال کننده شبیه رونویسی (TALENs) شامل پروتئین های TALE باکتریایی است که با اندونوکلئازها مانند FokI ترکیب شده اند. مانند ZFN ها ، برای شروع شکستن DNA نیاز به اتصال جفتی دارد.
در اینجا ویژگی هدف گیری DNA از آرایه های TALE ماژولار ناشی می شود که برای تشخیص توالی های جانبی DNA به هم متصل شده اند ، اما هر TALE فقط یک نوکلئوتید واحد را تشخیص می دهد.
پلتفرم CRISPR/Cas9 مانند ZFN ها و TALEN ها به اتصال پروتئین به DNA متکی نیست ، اما ویژگی هدف گیری DNA خود را از زوج پایه Watson-Crick RNA-DNA RNA راهنما (gRNA) با محل تشخیص می گیرد.
در ابتدا Cas9 به موتیف مجاور protospacer (PAM) متصل می شود ، این یک توالی DNA 2-6 جفت باز است که مخصوص هر پروتئین Cas است.
بدون دنباله صحیح PAM ، Cas DNA را متصل یا قطع نمی کند. پس از شناسایی صحیح PAM ، Cas باقی مانده DNA را ذوب می کند تا مکمل توالی «gRNA »را آزمایش کند.
اتصال PAM به پروتئین Cas اجازه می دهد تا به سرعت اهداف بالقوه را غربال کرده و در حین جستجوی توالی های کاملاً مکمل از ذوب تعداد زیادی توالی غیر هدف جلوگیری کند.
«نوکلئوتیدها» چیست؟
نوکلئوتید، یک مولکول آلی است که واحد سازنده اسیدهای نوکلئیک DNA و RNA به شمار میرود. به جرات میتوان گفت نوکلئوتیدها درون زنجیره DNA، ماده ژنتیکی همه موجودات زنده شناخته شده را تشکیل میدهند و آن را به نسلهای بعدی منتقل میکنند. اما علاوه بر ذخیره و انتقال اطلاعات ژنتیکی، نوکلئوتیدها نقشهای دیگری را نیز در سلول بر عهده دارند. به عنوان مثال، میتوان به عملکرد آنها در قالب مولکولهای حامل انرژی اشاره کرد. علاوه بر این، نوکلئوتیدها نقشهایی را در فرایندهای مربوط به سیگنالینگ (انتقال پیام) سلولی، متابولیسم و واکنشهای آنزیمی بر عهده دارند.
نمای شماتیک نوکلئوتید ATP.
چهار نوع نوکلئوتید موجود در DNA
چهار باز نیتروژنی آدنین، سیتوزین، گوانین و تیمین در ساختمان DNA به کار میروند. در مولکول RNA نوکلئوتید حاوی یوراسیل، جایگزین تیمین میشود.
ساختار نوکلئوتید، به تنهایی، ساده است، اما از کنار هم قرار گرفتن نوکلئوتیدها، ساختار بلند و پیچیدهای ایجاد میشود که ممکن است DNA خطی یا حلقوی، یا هریک از انواع RNA باشد. در ادامه، تصویری از DNA را مشاهده میکنید. این مولکول از دو رشته تشکیل شده است که به دور یکدیگر پیچیده شدهاند. همانطور که در تصویر مشخص است، بهترین آرایش نوکلئوتیدها در حالتی است که حداکثر تعداد پیوندهای هیدروژنی بین آنها ایجاد شود.
مارپیچ دورشتهای DNA.
پیوند درون هر رشته، از نوع «فسفودیاستری» است که یکی از انواع پیوندهای محکم «کووالانسی »به شمار میرود. دو رشته با پیوندهای هیدروژنی به یکدیگر متصل شدهاند. هرچند این پیوند، به تنهایی، جزو پیوندهای شیمیایی ضعیف به شمار میرود، اما خاصیت تعاونی آن موجب میشود، در مجموع، یک اتصال قوی بین دو رشته، شکل گیرد و آن را به حالت پایدار نگه دارد. تشکیل چنین ساختار پایداری، به دلیل وجود ویژگیهای بیوشیمایی نوکلئوتیدهاست.
هر نوکلئوتید، فقط میتواند با یک نوع نوکلئوتید دیگر، پیوند هیدروژنی برقرار کند(جفت شود). تصویر بالا، پیوند تیمین به آدنین و پیوند گوانین به سیتوزین را نشان میدهد.
اگر رشتهای از نوکلئوتیدها، به همین ترتیب، به رشته دیگری جفت شود، سرانجام، مانند یک زیپ، یک مولکول دو رشتهای بلند، ایجاد میشود که دو زنجیره آن، به دور یک محور فرضی، پیچیدهاند و در تمام طول خود، کاملا صاف و هموار، هستند. اما اگر در ناحیهای از این مولکول، یک نوکلئوتید، با نوکلئوتید مقابل خود، جفت نشود، به صورت یک برامدگی دیده خواهد شد.
یکی از راههایی که پروتئینها میتوانند DNA آسیب دیده را ترمیم کنند، شناسایی و اتصال به این نقطههای برامده موجود در ساختار DNA است. در این حالت، پروتئین ترمیمی، نوکلئوتید غلط را برش داده و آن را جایگزین میکند. ماهیت دورشتهای بودن ساختار ژنوم، تضمین میکند که خطاهای از این دست، با دقت بالایی قابل اصلاح هستند.
در اعضا لنفاوی ثانویه، لنفوسیت های B با سلول های دندریتی فولیکولی پراکنده واکنش نشان می دهند.این سلول ها دارای زوائد فیلامانی بلندی هستند و برخلاف دیگر سلول های دندریتی، دارای منشا مزانشیمی می باشند و عمکرد ان ها وابسته به مولکول های MHC کلاس 2 نیست. سطح این سلول ها توسط کمپلکس آنتی ژن_ آنتی بادی پوشیده شده که به پروتئین های کمپلمان و نواحی Fc ایمونوگلوبولین وصل شده و د رنهایت به سلول های B متصل می شوند و آن ها را فعال می نمایند. نتیجه این اعمال ایجاد گره های لنفاوی کوچک اولیه است. با کمک و همراهی لنفوسیت های T در مجاورت این ساختمان ها ، سلول های B به تدریج گروه های بزرگتری به نام گره های لنفاوی ثانویه را ایجاد می نمایند.
جهش DNA
عوامل جهشزا، موجب تغییر در شکل ظاهری DNA میشوند. پروتئینهای ترمیمی، این نواحی را شناسایی و آنها را ترمیم میکنند.
ساختمان هر پروتئین و نهایتا هر مولکول زیستی، محصول اطلاعات موجود در توالی نوکلئوتیدی ژنوم سلول است. آشنایی با ویژگیهای ساختاری و بیوشیمیایی نوکلئوتیدها، گام نخست در یادگیری مباحث پیچیدهتر علم ژنتیک به شمار میرود.
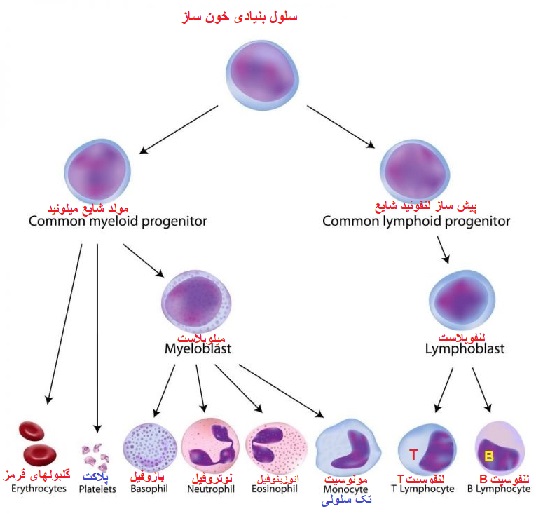
منشا سلول های تک هسته ای خون محیطی
سلول های تک هسته ای خون محیطی از سلول های بنیادی خونساز (HSC) که در مغز استخوان قرار دارند سرچشمه می گیرند. HSC ها از طریق فرایندی به نام خون سازی یا هماتوپوئز باعث تولید کلیه سلول های خونی و سیستم ایمنی بدن می شوند. سلول های بنیادی خونساز، از طریق خونسازی پیشرفت می کنند و سلول های میلوئیدی (مونوسیت ها، ماکروفاژها، گرانولوسیت ها، مگاکاریوسیت ها، سلول های دندریتی، گلبول های قرمز) و لنفوئید (سلول های T، سلول های B، سلول های NK) را تولید می کنند.
درون هر دو رده سلول هایی هستند که PBMC ها را تشکیل می دهند. PBMC ها سلول های خونی با هسته های گرد هستند که جمعیت سلول های ناهمگنی را شامل می شود که شامل جمعیت های مختلف لنفوسیت ها (سلول های T، سلول های B و سلول های NK)، سلول های دندریتیک و مونوسیت ها است. این سلول ها اجزای حیاتی سیستم ایمنی ذاتی و تطبیقی هستند که از بدن در برابر عفونت ویروسی، باکتریایی و انگلی محافظت کرده و سلول های توموری و مواد خارجی را از بین می برند.
فراوانی جمعیت های مختلف سلول ها در PBMC
جمعیت سلول های انسانی در هر فرد متفاوت است، اما به طور متوسط ، بیشتر PBMC ها را لنفوسیت ها تشکیل می دهند. لنفوسیت ها نقش اساسی در پاسخ های ایمنی سلولی و ایمنی هومورال دارند که در درجه اول، با فعال شدن سلول های T و B در ارتباط است.
در جمعیت لنفوسیت ها، سلول های CD3 + T مهمترین بخش سلولی (70-45٪) هستند. اکثر سلول های T به عنوان سلول های T ساده و در حال استراحت وجود دارند. این ها سلول های T هستند که توسط آنتی ژن فعال نشده اند و یا به عنوان سلول های T حافظه عمل می کنند. فعال شدن سلول های T ساده از طریق شناسایی آنتی ژن رخ می دهد و جمعیت کمی از سلول های T را در افراد سالم تشکیل می دهد. سلول های T پس از فعال شدن، یک پاسخ ایمنی سلولی را شروع می کنند که آنتی ژن های درون سلول آلوده یا بیمار را مورد هدف قرار می دهد.
به طور مشابه، سلول های CD19 + B به عنوان سلول های ساده یا حافظه ای وجود دارند که در انتظار فعال شدن توسط آنتی ژن هستند و فقط 5-15٪ از کل جمعیت لنفوسیت ها را تشکیل می دهند. سلول های B پس از فعال شدن، به سلول های پلاسما متمایز می شوند که قادر به ترشح آنتی بادی هایی هستند که به طور خاص آنتی ژن های آزاد گردش یافته در جریان خون را هدف قرار می دهند. توانایی هدف قرار دادن آنتی ژن های آزاد توسط آنتی بادی های ترشحی در فضای خارج سلول به عنوان پاسخ ایمنی هومورال تعریف می شود.
سلول های NK بخش کوچکتری از جمعیت لنفوسیت ها را تشکیل می دهند (5-10٪). این سلول ها بدون نیاز به آنتی ژن عملکرد موثر خود را انجام می دهند و از بدن در برابر فعالیت تومور دفاع می کنند.
بخش کوچکی از گلبول های سفید شامل سلول های دندریتیک (1-2٪) است که یک رابط حیاتی بین سیستم ایمنی ذاتی و سازگار را تشکیل می دهد. سلول های دندریتیک، یک سلول ارائه دهنده آنتی ژن بسیار تخصصی، آنتی ژن ها را بلعیده و قطعات آنتی ژنی را به سلول های سیستم ایمنی تطبیقی ارائه می دهد که باعث فعال شدن سلول های T و B می شود.
«مونوسیت» ها از نظر پیچیدگی و اندازه با «لنفوسیت» ها متفاوت اند.، مونوسیت ها (10-30٪) در جریان خون و بافت محیطی گردش می کنند و هنگامی که تحریک می شوند، بالغ می شوند و به سلول های «دندریتیک»(ماکروفاژها) متمایز می شوند که به عملکرد پاسخ های ایمنی ذاتی و اکتسابی کمک می کنند و به عنوان سلول های «فاگوسیتیک»(گلبول های سفید خون) و ارائه دهنده آنتی ژن عمل می کنند.
سلول های بنیادی خون ساز
«سلول های بنیادی خونساز» از اهمیت بسیار بالایی برخوردارند.
HSC ها در خون و مغز استخوان باعث تولید کلیه سلول های موجود در خون از جمله گلبول های قرمز خون، پلاکت ها، لنفوسیت ها، مونوسیت ها و گرانولوسیت ها می شوند. برای پیوند سلول های بنیادی، جمعیت این سلول نادر است و فقط 0.1-0.2٪ از بخش PBMC را تشکیل می دهد و جدا کردن آن ها از نمونه های خون کامل دشوار است.
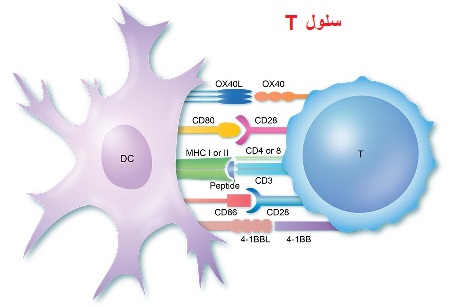
«سلول T» چیست؟
«سلول T»نوعی لنفوسیت یا گلبول سفید است.
مغز استخوان سلولهای T را به شکل سلولهای نمونه تولید میکند و آنها به غده ی T موس می روند که به آن «سلول T» می گویند.
جداسازی سلول های تک هسته ای خون محیطی
دو روش اصلی برای جداسازی سلول های تک هسته ای خون محیطی از خون کامل وجود دارد. به کمک استفاده از سانتریفوژ توسط ایجاد شیب تراکم یا با استفاده از لوکافر.
از آنجا که سلول ها دارای تراکم خاصی هستند، استفاده از فرآیند سانتریفیوژ با شیب تراکم، جمعیت سلول های اصلی مانند لنفوسیت ها، مونوسیت ها، گرانولوسیت ها و سلول های قرمز خون را از طریق ایجاد یک شیب تراکمی جدا می کند. برای سلول های انسانی، تراکم محیط 1.077 گرم در میلی لیتر امکان جداسازی کافی PBMC ها (تراکم 1.077 گرم در میلی لیتر) از سلولهای قرمز خون و گرانولوسیت ها (تراکم> 1.077 گرم در میلی لیتر) را فراهم می کند. پس از سانتریفیوژ، PBMC به عنوان یک لایه سفید نازک بین پلاسما و محیط ایجاد کننده شیب چگالی ظاهر می شود که جداسازی آن ها را آسان می کند.
دستگاه leukapheresis وسیله ای خودکار است که با استفاده از سانتریفیوژ با سرعت بالا، PBMC را از خون کامل جدا می کند.
توضیح مدیریت سایت-پیراسته فر: برای اطلاع جامع ازفنآوری «کریسپر» به این لینک مراجعه کنید:
دستکاری درژنها DNAویرایش ژنها،تولدموجودات زنده وانسانها
تفاوت کریسپر(CRISPR) با تراریخته(GMO) چیست؟
تفاوت کریسپر(CRISPR-Cas۹) با تراریخته(GMO) باغیرتراریخته(GEO) چیست؟
(GMO)«تراریخته»(Genetically Modified Organism)
(GEO)«غیرتراریخته» (Gene Edited Organism)
آیا « کریسپر» ،همان «تراریخته» است؟
« مجتبی پویان مهر»(کارشناس کشاورزی):هرکدام از روشهای تراریخته و ویرایش ژنوم (کریسپر) تعریف مشخصی دارند.
زمانی که ما یک ژن خارجی از یک گونه غیرقابل تلاقی به موجود هدف منتقل میکنیم، موجود حاصل را «ترانس ژن» یا «تراریخته» مینامند. ولی وقتیکه هیچ «ژن خارجی» وارد موجود زنده نشده و فقط «ویرایش ژنوم» خود موجود زنده انجام شده باشد، دیگر موجود حاصل را تراریخته نمینامند.
برتری «کریسپر» نسبت به «تراریخته»
مزیت اصلی «کریسپر» هم «ویرایش ژنومی» و اصلاح صفات بدون استفاده از DNA خارجی است. ولی این بدان معنی نیست که با استفاده از «کریسپر» نمیتوان موجودات «ترانس ژن» نیز تولید کرد!.
روش «اینزرت ژن» یا وارد کردن قطعه DNA خارجی با «فنآوری کریسپر» را اصطلاحاً «Targeted Insertion» یا «Smart Gene Integration» مینامند.
و «مزیت انتقال ژن با روش کریسپر» نسبت به «تراریخته» ، دقت بالای انتقال ژن به جایگاه هدف و پایداری ژن منتقل شده است.
اما در این حالت هم اگر قطعات واردشده به «ژنوم »ارگانیسم هدف، منشأ غیر داشته باشند و از گونه های غیرقابل تلاقی انتخاب شوند، بر مبنای تعریف ارائهشده توسط مراجع ذیصلاح در آمریکا و اروپا، محصول تولیدشده بهعنوان تراریخته (GMO) تلقی میشود و در غیر این صورت خیر.
اما همانطور که عرض کردم عمده کاربرد تجاری فناوری کریسپر در دنیا «ویرایش ژنوم» است نه «ترانس ژن کردن موجودات». اصلاً مزیت این روش هم که از عهده سایر تکنیکها برنمیآید ویرایش دقیق ژنهاست و دانشمندان هم دقیقاً روی همین قابلیت فنآوری «کریسپر» تمرکز کردهاند.
« پویان مهر» می گوید:بنابراین به لحاظ فنی محصولات حاصل از ویرایش ژنومی کریسپر؛ تراریخته (GMO) نیستند، بلکه «غیرتراریخته» (GEO) یا Gene Edited Organism نامیده میشوند. این به لحاظ تکنیکال و فنی بود،
اما در سیاست ها و قانونگذاری های کشورهای مختلف این قاعده متفاوت است. بهطور مثال بنا بر ارزیابی های کمیسیون اروپا، محصولات حاصل از روشهای نوین مولکولی در اصلاح نباتات (New Breeding Techniques) که تکنیک کریسپر نیز در این گروه دستهبندی می شود؛ همچون گیاهان اصلاحشده به روش کلاسیک هستند.
این موضوع در سندی با عنوان «وضعیت مقررات گیاهان حاصل از شیوه های نوین اصلاح مولکولی» (The Regulatory status of plants resulting from New Breeding Technologies)، در سال ۲۰۱۳ از طرف کمیسیون اروپا منتشر شد و در آن اشاره شده که با بررسی اسناد موجود کمیسیون اروپا در رابطه با قوانین مربوط به تراریخته ها و غیر تراریخته ها در اتحادیه اروپا (Dir. ۲۰۰۱/۱۸/EC)، نتیجه گیری می شود که محصولات حاصل از (NBT) نمی توانند ذیل قوانین تراریخته تعریف شوند. اما همانطور که قبلاً عرض کردم پس از کشوقوسهای فراوان بین کشورهای مختلف اتحادیه اروپا، نهایتاً امسال اتحادیه اروپا موضع رسمی کل اتحادیه را برخلاف نظرات قبلی کمیسیون اروپا اعلام کرد و اعلام شد که ازنظر اتحادیه اروپا محصولات حاصل از کریسپر هم ذیل قوانین تراریخته خواهند رفت!
شماگفتید که در آمریکا محصولات کریسپری ذیل قوانین محصولات کلاسیک هستند ولی با این مطلبی که الان اشاره کردید؛ مواضع اتحادیه اروپا در قانونگذاری پیرامون این موضوع متفاوت است. این تفاوتهای قانونگذاری کشورها از چه چیزی ناشی می شود؟
«مهندس مجتبی پویان مهر»:بله در قانونگذاری آمریکا بسیاری از موجوداتی که تحت تغییرات «کریسپر» قرار بهعنوان موجودات دستکاری ژنی شده شناخته نمی شوند. یعنی عکس قانونگذاری اتحادیه اروپا در کشور آمریکا دیده می شود و ازنظر مراجع ذیصلاح این کشور جهش های ناشی از کریسپر هیچ تفاوتی با جهش های طبیعی ندارند و محصولات حاصل از ویرایش ژنوم همانند محصولات اصلاحشده به روش کلاسیک دسته بندی می شوند.
دلیل این امر سیاست های آمریکا است که محصول-محور (Product-based) است و تا زمانی که کریسپر قطعات خارجی را وارد ژنوم موجود زنده نکند محصول حاصل از آن (موجودات ویرایش شده ژنتیکی) جزو محصولات تراریخته حساب نخواهند شد. حتی درصورتیکه ویرایش ژنتیکی همراه با انتقال قطعات ژنتیکی از یک موجود خویشاوند باشد نیز ممکن است محصول حاصله متمایز از آن چیزی نباشد که در تلاقی اصلاحی سنتی حاصل می آید و بر همین مبنا دانشمندان این محصولات را نیز بهعنوان محصولات طبیعی (یعنی محصولی که دستکاری ژنتیکی نشده باشد) بهحساب می آورند.
اما قوانین در اتحادیه اروپا کمی متفاوت است و عبارت (GMO) بر اساس محصولات (Product) تعریف نمی شوند، بلکه بر مبنای فرآیند طی شده (Process) تعریف می شود و قوانین این حوزه فرآیند-محور (Process-based) هستند.
بدین معنا که فرایند مورداستفاده در تولید این محصول تعیینکنندهی قابلیت آزادسازی آن در بازار خواهد بود. بنابراین در حال حاضر طبق قوانین فعلی اتحادیه اروپا هر محصولی که با روش های مورداستفاده در مهندسی ژنتیک تولید شود، باید با برچسب (GMO) در بازار عرضه شود.
البته همانطور که قبلاً عرض کردم این دیدگاه در همه کشورهای اروپایی حاکم نیست چنانچه در حال حاضر کشورهایی مثل فرانسه، آلمان، فنلاند و سوئد فناوری کریسپر را تجاریسازی کردهاند و این تولیدات مانند محصولات تراریخته ممنوع نیستند. برخی از کشورهای عضو اتحادیه اروپا روش خود را پیشگرفتهاند. برای مثال سوئد در سال ۲۰۱۵ و فنلاند در سال ۲۰۱۶ اعلام کردند که محصولات ویرایش ژنی شده غیرتراریخته هستند و دانشمندان خود را برای پیشبرد آن تشویق کردند. هلند نیز اعلام کرد که بسیاری از روشهای ویرایش ژنومی باید طبق قانون از روشهای تراریخته مستثنا شوند.
توضیح مدیریت سایت-پیراسته فر:برای اطلاع ازسازوکارهای«ژنوم»به این لینک مراجعه کنید:
Genomeژنوم چیست؟DNA
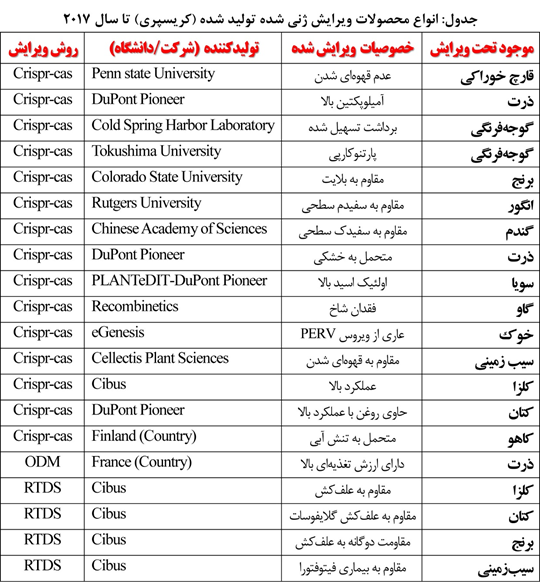
در بخشهایی از صحبتهای خود به محصولات کریسپری تجاریسازی شده در آمریکا و برخی کشورهای اروپایی اشاره کردید. امکانش هست یکبار دیگر کل محصولات غذایی که بهوسیله کریسپر در دنیا تولید شدهاند را نام ببرید؟
«مجتبی پویان مهر»:همانطور که پیشتر عرض کردم برخی «محصولات کریسپری» هماکنون در بازارهای جهانی عرضه شدهاند که بنده لیست آنها را میتوانم در اختیار شما بگذارم.
برخی محصولات دیگر نیز بهوسیله دانشگاهها تولید شدهاند و در صف تجاریسازی و واگذاری به شرکتهای سرمایهگذار هستند که ممکن است طی ماههای آینده وارد بازار شوند (جدول زیر).
آیا ویژگیهای منحصربهفردی که کریسپر برای دانشمندان فراهم کرده است از عهده سایر تکنیکهای مهندسی ژنتیک برنمیآید؟ بهطورکلی آیا تمام دانشمندان این فناوری را تائید کردهاند یا هستند کسانی که به آن انتقاداتی وارد میکنند؟
«مجتبی پویان مهر»:به همراه ظهور هر فناوری جدید همیشه انتقاداتی نیز پیرامون آن مطرح میشوند و اتفاقاً این خوب است و موجب پیشرفت و بهینهتر شدن فناوری های نوظهور میشود. در مورد کریسپر هم باید بگویم پیشرفت آن با سرعت بالایی طی می شود .
آقای مهندس کشاورزی «مجتبی پویان مهر»می گوید:اگر امروز از من در مورد این فناوری سؤالی می کنید ممکن است پاسخ امروز من به این سؤال، با پاسخ فردا که این فناوری به حد بهینه تری رسیده است، متفاوت باشد!
ولی چیزی که در حال حاضر اکثر دانشمندان پیرامون آن متفقالقول هستند این است که با تکنیک کریسپر، سرعت و دقت دست ورزی ژنها افزایش پیدا کرده است.
خانم «پاملا رولاند»(Pamela Roland) -دانشمند حوزه ژنتیک دانشگاه دیویس- طی مصاحبهای که در نیچر از ایشان منتشر شد اظهار کرده بودند: «شما با استفاده از کریسپر می توانید حتی یک جفت باز را تغییر دهید یا یک ژن بهخصوص را با دقت بسیار بالایی حذف (یا ویرایش) کنید...» و همین دانشمند، محصولات حاصل از تکنیک کریسپر را با عنوان «Organic GMOs» یاد می کند! بنابراین دقت و سرعت و توانایی پیگیری تغییرات ژنومی اعمالشده در این روش، بلاشک از تکنیکهای پیشین (حتی ,ZFN ,Meganuclease I-SceI SDNو ...) بیشتر است.
اما برخی از دانشمندان، بر عبارت «دقت و صحت» در سیستم «اصلاح دقیق»(Precision Breeding) کریسپر انتقاد دارند.
توضیح مدیریت سایت-پیراسته فر:احتمالاً عنوان«اصلاح دقیق» باید(Precision Correction)باشد.
بهطور مثال یکی از منتقدان کریسپر در امریکا «چارلز بن بروک»(Charles Benbrook)مرکز کشاورزی پایدار و منابع طبیعی دانشگاه ایالتی واشینگتن- است. ایشان بر اثرات ناخواسته یا Off target احتمالی این تکنیک اشاره میکنند و بر این ادعا هستند که کریسپر ویرایش ها و جهشهای ناخواستهای را نیز میتواند در پی داشته باشد.
آیا واقعاً کریسپر تغییرات ناخواسته و غیر هدف را نیز ایجاد میکند!؟ این تغییرات ممکن است خطرناک باشند؟
«مجتبی پویان مهر»در پاسخ به این سؤال باید گفت که نهتنها تکنیک کریسپر، بلکه تمامی تکنیکهای مهندسی ژنتیک و تغییر ژنها اثرات غیرقابلانتظاری را در پی دارند و این امر غیرقابلاجتناب است. ولی نکتهای که باید توجه کنیم این است که فراوانی چنین اثرات غیرقابلانتظاری در کدام تکنیک کمتر و قابلپیگیریتر است؟
وقوع برشهای غیر هدف منجر به «موتاسیون»های حذف و اضافه (InDels) در جایگاههای غیر هدف« ژنوم »میزبان میشود و درنتیجه فنوتیپ (صفت) ناخواسته را ایجاد میکند. مطالعات زیادی این موضوع را در کریسپر گزارش کردهاند که در این روش عموماً عدم اتصال یا Mismatches مربوط به انتهای 5gRNA molecules رخ میدهد. ولی در کل اثرات غیر هدفمند ایجادشده توسط این سیستم ازنظر تعداد متفاوت است و پیشبینی آن تقریباً غیرممکن میباشد.
بااینکه تغییرات غیر هدف اتفاق افتاده در فرآیند مهندسی ژنتیک در مرحله بروز فنوتیپ و یا ژنوتایپینگ قابلشناسایی و حذف شدن هستند، اما دانشمندان بهمنظور پیشگیری از وقوع تغییرات غیر هدف (Off-target) و موزاییکی شدن سلولها بهواسطه کریسپر، راهکارهایی گزارش کردهاند که تعدادی از آنها عبارتاند از:
استفاده از نوکلئاز Cas۹ جهشیافته (نظیر آنزیم Cas۹ Nicakse و یا آنزیم Cas۹ دوموتانه (Cas۹ Double Mutant): برای مثال آنزیم نیکاز Cas۹ فرم جهشیافتهای از آنزیم Cas۹ است که یکی از دومِینهای نوکلئازی RuvC۱ و یا HNH به دلیل جهش مصنوعی القا شده در دومِینRuvC۱ )و تغییر اسیدآمینه ۸۴۰ ام از هیستیدین به آلانین (H۸۴۰A) در دومین (HNH قادر به برش دو رشته DNA نبوده و فقط یک رشته را میبُرد. در این وضعیت DNA بریدهشده در یکرشته یاnick ، در صورت وجود DNA همولوگ، بهصورت نرمال بهسرعت و از طریق مکانیسم مسیر ترمیمی شباهتی (HDR) ترمیم میشود و درنتیجه اثرات نامطلوب off-Target کاسته خواهد شد. البته در هنگام استفاده از آنزیم Cas۹ نیکاز به دو مولکول gRNA بهجای یک مولکول نیاز است. دو مولکول gRNA بایستی علیه دو رشته سنس و آنتی سنس DNA هدف و نزدیک به هم طراحی شوند تا این اطمینان را به محقق بدهند که زمانی برش دو رشتهای (DSB) اتفاق خواهد افتاد که هر دو رشته سنس و آنتی سنس DNA بهصورت تکی یا nick برش بخورند. سپس بهمحض اینکه DSB ایجاد شد، یکی از مسیرهای ترمیمی NHEJ یا HDR بهمنظور کامل کردن فرایند ویرایش ژنوم وارد عمل میشوند.
استفاده از روشTruncated Guide RNAs (Tru-sgRNA): در این روش طول ریبونوکلئوتید راهنما (sgRNA) کاهش مییابد که این عامل خاصیت جهشزایی غیر هدف را کاهش میدهد. استفاده از آنزیم Cas۱۲: این آنزیم بهتازگی کشف شده است و بنا به آزمایشات صورت گرفته اختصاصیتر از آنزیم Cas۹ عمل میکند. استفاده از آنزیم NmeCas۹: این آنزیم نیز در سال ۲۰۱۸ معرفی شد و با استفاده از آن ما میتوانیم بدون اینکه خود ژن را دستکاری کنیم، رشته mRNA حاصل از توالی ژن یا رونوشت ژن را ویرایش کنیم و بدین ترتیب بدون اینکه تغییری در توالی DNA (و دامن زدن به تغییرات غیر هدف احتمالی) را داشته باشیم، موجود موردنظرمان را ویرایش ژنی کنیم. اما نکته دیگر که عرض میکنم حتی باوجود افزایش دقت و صحت، در این تکنیک هم هیچ تضمینی وجود ندارد که تمام نتایج مورد انتظار محقق بهطور دقیق حاصل آیند! نه در این روش؛ بلکه در تمامی تکنیکهای مهندسی ژنتیک چنین است و بهطور مطلق نمیتوانیم ادعای نتیجه صددرصدی استحصال صفت موردمطالعه در موجود هدف را داشته باشیم! در گیاهان مطالعات مهندسی ژنتیک پیچیدهتر از سایر موجودات است؛ چراکه بهطور مثال می دانیم که صفاتی مثل تحمل به خشکی و شوری نهتنها بهواسطه ژنهای بسیاری کنترل میشوند، بلکه بهشدت تحت تأثیر شرایط محیطی نیز هستند. بسیاری از عملکرد ژنها وابسته به میزان تبخیر و تعرق، دما و اقلیم منطقه، فلورباکتریایی خاک، عمق خاک و ... است. علاوه بر این، بِیس یا زمینه ژنتیکی هرکدام از گونهها یا محصولات .کشاورزی رفتار ژنهای مربوط به آن را متأثّر می کند
پس در مهندسی ژنتیک هم نظیر اصلاح کلاسیک ممکن است تغییرات غیر هدف حاصل شود؟
«مجتبی پویان مهر»:بله تغییر در هر ژن و با هر تکنیکی میتواند مجموعه های از تغییرات غیرقابلپیشبینی را در پی داشته باشد. بیشترین آنها با جهش زایی از طریق پرتوتابی هاست و کمترین شان در اصلاح کلاسیک است. اما در سال ۲۰۱۸ که ما هماکنون زندگی میکنیم کدامیک از تکنیکهای مهندسی ژنتیک تغییرات غیرقابلپیشبینی کمتر و درعینحال قابلپیگیریتری در سلولهای موجودات زنده در پی دارند؟
بنا به یافتههای فعلی حوزه مهندسی ژنتیک تکنیک کریسپر این ویژگی را دارد! چراکه بهواسطه روشهایی مثل: Targeted sequencing، Exome sequencing، Whole genome sequencing، GUIDE-seq، Digenome-seq و ... تغییرات Off target محصولات حاصل از کریسپر شناسایی شدهاند و قابلردیابی، انتخاب و حذف هستند (جدول زیر).
«مجتبی پویان مهر»: آیا «کریسپر» میتواند گزینه مناسبی برای حل مناقشات «تراریخته ها» باشد یا خیر!؟
توضیح مدیریت سایت-پیراسته فر:این سئوالی است که «مجتبی پویان مهر»دراین مصاحبه مطرح می کند وپاسخش رااینگونه می دهد:پاسخ این سؤال ازنظر اکثر دانشمندان «بله» هست!
«پویان مهر»درادامه گفت:اما برای حصول اطمینان از سبقت منافع از اثرات منفی این فناوری نیازمند تغییری جدی و انقلابی در تکنیکها و کاربریهای مهندسی ژنتیک و همافزایی بین سایر علوم؛ نظیر بیوانفورماتیک یا دادهپردازی زیستی هستیم.
«ژنوم بومی »چیست؟
«پویان مهر» گفت:یک نکته ظریف دیگر که به نظرم میرسد عرض کنم این است که در بسیاری از موارد، ژنهای خاصی تنها درزمینهی ژنتیکی و محیطی خاصی مورداستفاده قرار میگیرند. اگر بخواهیم یک سیستم کشاورزی برای اکوسیستمهای بومی ایجاد کنیم که برای خاک، آبوهوا و عملیات زراعی بومیان همان منطقه کاربرد بهینه و پایدار داشته باشد،« ویرایش ژنومی گیاهان و جانوران بومی همان منطقه یکی از بهترین راهحلها است.»
بدان معنا که باوجود امکان استفاده از ارقام ویرایش شدهی یک مرکز تحقیقاتی در سراسر جهان، اما اگر به دنبال کشاورزی پایدار (به معنای واقعی و نه به معنای رکود تولید!) و اقتصادی مقاوم هستیم باید از ذخایر ژنتیکی بومی در هر منطقه که با گذشت قرنها به پایداری و سازگاری مطلوبی با محیط پیرامونی و اقلیم خاص منطقه رسیدهاند، برای مقابله با تهدیدها استفاده شود. با این کار علاوه بر حفظ تنوع ژنتیکی، مانع از بروز هرگونه اختلافات سیاسی، حقوقی و یا اخلاقی دراینباره می شویم.
با توجه به اینکه فناوری را مساوی اقتدار قلمداد کردید به نظر شما رویکرد صحیح کشور ما نسبت به این فناوری نوظهور باید چگونه باشد؟
«مجتبی پویان مهر»:کلید تصمیمگیری صحیح برای این موضوع، در نخستین گام؛ درک صحیح این موضوع است که همه کاربردهای کریسپر به یک صورت انجام نمی شوند و یا مفاهیم یکسانی در پایداری نظام کشاورزی ندارند. البته سرعت پیشرفت فناوریهای مهندسی ژنتیک بسیار بالاست و دانشمندان روی بهینه کردن تکنیکهای موجود هرروز کار میکنند. ولی در حال حاضر ویرایش ژنومی (کریسپر) بهروزترین فناوری مهندسی ژنتیک در دنیاست و همانطور که سایر کشورها برای پیشرفت در این عرصه برنامهریزی کردهاند، کشور ما نیز باید در اولویتهای تحقیقاتی خود روی بومیسازی این فناوری برنامه داشته باشد. البته این تکنیک نیز همچون سایر روشهای اصلاحی و بیوتکنولوژی، ممکن است در عرصه تجاری سازی و تولیدات انبوه، عواقب مثبت و منفی در پی داشته باشد که میطلبد ازنظر تأثیرات اجتماعی و زیستمحیطی بومی مورد ارزیابی قرار بگیرد و بسته سیاستی مناسبی برای ارزیابیهای آن مدنظر داشته باشیم.
در این بسته های سیاستی هم باید کریسپر را نه بهعنوان یک فناوریِ صرف، بلکه بهعنوان «جعبه ابزاری کامل از فناوری ها» موردتوجه قرارداد که هرکدام از آنها برای یک جهش، یک موجود زنده و یک اکوسیستم، اختصاصی هستند. بهطورکلی بررسی و تهیه دیدگاه های همهجانبه و کافی از خطرات، سبک و سنگین کردنها، و بررسی هزینه-فرصتها نیازمند «مهندسی کریسپر» است که منوط به تضارب آرا و انتقادهاست که این فناوری را به تکامل و پختگی بیشتری برساند./۱۶ دی ۱۳۹۷خبرگراری مهر

توضیح مدیریت سایت-پیراسته فر:برای اطلاعات جامع از«تراریخته» و«محصولات تراریخته» به این لینک مراجعه کنید:
تراریخته چیست؟کدام محصولات غذایی تراریخته است؟
خبرگزاری مهر(۱۹ آبان ۱۳۹۷)نوشت:با ظهور فناوری نوین مهندسی ژنتیک به نام کریسپر، برخی کشورهای دنیا مجوزهای آزادسازی متعددی برای انواع محصولات ویرایش ژنی شده با روش کریسپر را صادرکردهاند.
با توجه به اینکه فناوری را مساوی اقتدار قلمداد کردید به نظر شما رویکرد صحیح کشور ما نسبت به این فناوری نوظهور باید چگونه باشد؟
«مجتبی پویان مهر»:کلید تصمیمگیری صحیح برای این موضوع، در نخستین گام؛ درک صحیح این موضوع است که همه کاربردهای کریسپر به یک صورت انجام نمی شوند و یا مفاهیم یکسانی در پایداری نظام کشاورزی ندارند. البته سرعت پیشرفت فناوریهای مهندسی ژنتیک بسیار بالاست و دانشمندان روی بهینه کردن تکنیکهای موجود هرروز کار میکنند. ولی در حال حاضر ویرایش ژنومی (کریسپر) بهروزترین فناوری مهندسی ژنتیک در دنیاست و همانطور که سایر کشورها برای پیشرفت در این عرصه برنامهریزی کردهاند، کشور ما نیز باید در اولویتهای تحقیقاتی خود روی بومیسازی این فناوری برنامه داشته باشد. البته این تکنیک نیز همچون سایر روشهای اصلاحی و بیوتکنولوژی، ممکن است در عرصه تجاری سازی و تولیدات انبوه، عواقب مثبت و منفی در پی داشته باشد که میطلبد ازنظر تأثیرات اجتماعی و زیستمحیطی بومی مورد ارزیابی قرار بگیرد و بسته سیاستی مناسبی برای ارزیابیهای آن مدنظر داشته باشیم.
در این بسته های سیاستی هم باید کریسپر را نه بهعنوان یک فناوریِ صرف، بلکه بهعنوان «جعبه ابزاری کامل از فناوری ها» موردتوجه قرارداد که هرکدام از آنها برای یک جهش، یک موجود زنده و یک اکوسیستم، اختصاصی هستند. بهطورکلی بررسی و تهیه دیدگاه های همهجانبه و کافی از خطرات، سبک و سنگین کردنها، و بررسی هزینه-فرصتها نیازمند «مهندسی کریسپر» است که منوط به تضارب آرا و انتقادهاست که این فناوری را به تکامل و پختگی بیشتری برساند./۱۶ دی ۱۳۹۷خبرگراری مهر
خبرگزاری مهر(۱۹ آبان ۱۳۹۷)نوشت:با ظهور فناوری نوین مهندسی ژنتیک به نام کریسپر، برخی کشورهای دنیا مجوزهای آزادسازی متعددی برای انواع محصولات ویرایش ژنی شده با روش کریسپر را صادرکردهاند.
تابهحال محصولات حاصل از کریسپر تجاریسازی شدهاند و یا در مرحله تحقیق هستند؟
« مهندس مجتبی پویان مهر»: بله. طبق مستندات مکتوب وزارت کشاورزی ایالت متحده (USDA)، دولت آمریکا تا سپتامبر سال ۲۰۱۷، مجوزهای آزادسازی متعددی برای انواع مختلف محصولات ویرایش ژنی شده را صادر کرده است. برخی از معروفترین محصولات کریسپری که هماکنون در بازار آمریکا یافت میشوند عبارتاند از: قارچ خوراکی مقاوم به قهوهای شدن (با نام تجاری Agicus Bisporus)، سیبزمینی مقاوم به قهوهای شدن (با نام تجاری Simplot)، کلزای روغنی با عملکرد بالا ( با نام تجاری ™SU Canola)، کتان حاوی روغن مفید (با نام تجاری Camelina sativa)، ذرت حاوی آمیلوپکتین بالا (DuPont Pioneer’s high amylopectin corn).
محصولات حاصل از کریسپر در آمریکا، تحت قوانین محصولات تراریخته قرار میگیرند؟
«مهندس بیوتکنولوژی و کارشناس توسعه اقتصادی و برنامهریزی»: خیر. در حال حاضر در کشور آمریکا محصولات حاصل از کریسپر با عنوان «غیرتراریخته»(Non-GMO) مجوز کشت و مصرف گرفته و در بازار یافت میشوند. چراکه همانطور که پیشتر عرض کردم اساساً شیوه تولید این محصولات متفاوت از محصولات تراریخته است. بنده تصویر برخی گزارشات USDA امریکا را در اختیارتان میگذارم که صریحاً اشاره میکنند: محصولات حاصل از کریسپر مشمول قوانین تراریخته این کشور نیستند و این تولیدات را نظیر محصولات حاصل از اصلاح سنتی (کلاسیک) معرفی میکنند (شکل زیر).
مواضع کشورهای اروپایی نسبت به این فناوری چیست؟ اشاره کردید که کشورهای اروپایی پس از چین و آمریکا بیشترین مطالعات را بر روی این تکنیک داشتهاند؛ این کشورها در مرحله تحقیقات باقی ماندهاند یا به مرز تولید و تجاریسازی هم رسیدهاند؟
پوان مهر:همانطور که میدانید مقامات کشورهای اروپایی حساسیتهایی نسبت به کشت محصولات تراریخته داشته و دارند و تا جایی که میدانم تا سال ۲۰۱۶ بهغیراز چهار کشور اسپانیا، پرتغال، اسلواکی و جمهوری چک که اقدام به کشت ذرت تراریخته کردهاند، باقی کشورها اجازه کشت و تجاریسازی این نوع محصولات را ندادهاند. در مورد محصولات حاصل از کریسپر هم گرچه تا حال اتفاقنظری بین کشورهای اروپایی وجود نداشته است، ولی شواهد نشان میدهد برخی کشورهای اروپایی این فناوری را پذیرفتهاند و تا مرحله تجاریسازی هم پیش رفتهاند. بنا به بررسیهایی که انجام شد، کمیسیون اروپا در پاسخ بهمواجهه این اتحادیه با محصولات حاصل از کریسپر، اعلام کرده بود که موضع رسمی کل اتحادیه اروپا در مورد محصولات حاصل از ویرایش ژنی را در اواخر سال ۲۰۱۸ اعلام خواهد کرد. اخیراً هم بنا بر اخباری که در رسانههای وابسته به اتحادیه اروپا منعکس میشود ظاهراً حکم اتحادیه اروپا در مورد محصولات حاصل از کریسپر همان حکم مربوط به محصولات تراریخته خواهد بود. (Wired.com).
اما برخی کشورهای اروپایی نظیر فرانسه، فنلاند و سوئد منتظر اعلام حکم اتحادیه اروپا نماندهاند و شواهد حاکی از آن است که این کشورها فناوری کریسپر در کشاورزی را پذیرفتهاند و هماکنون تعدادی محصول غذایی ویرایش ژنی شده نظیر ذرت ODM در فرانسه، کاهوی کریسپری در فنلاند و برخی محصولات دیگر در سوئد تولید و تجاریسازی شدهاند.
در کشور آلمان نیز آژانسهای نظارت بر مواد غذایی، بین محصولات GMO(تراریخته) و ویرایش شده با CRISPR- Cas۹ تفاوت قائل شدهاند. این نشانهها حاکی از آن است که احتمالاً به زودی محصولات تولید شده توسط کریسپر نسبت به هر نوع خوراکی یا داروی مهندسی ژنی شده دیگری در جهان فراوانتر شوند.
در دنیا تابهحال چه محصولات پرمصرفی با فناوری کریسپر تولید شدهاند؟
« مهندس مجتبی پویان مهر»: برنج یکی از پرکاربردترین غلات در جهان است که توسط کریسپر ویرایش شده است. این محصول اصلیترین منبع انرژی بسیاری از مردمان قاره آسیا است. تا اواخر سال ۲۰۱۷ حدود ۸۰ مقاله برای استفاده از کریسپر برای برنج در مجلات معتبر بینالمللی گزارش شده است. بنابر این گزاشات، تکنیک کریسپر در برنج میتواند جهشهایی را در جایگاه هدف با کارایی ۱۰۰درصد ایجاد کند.
در مورد صفات کیفی مهمی که به دنبال افزودن در ژنوم این گیاه با استفاده از کریسپر هستند نیز چندین گزارش را مطالعه کردهام. برای مثال بیماری بلاست یکی از مخربترین بیماریهای برنج در سطح جهان است که دانشمندان سعی میکنند به واسطه فناوریهای مهندسی ژنتیک بر این بیماری فائق آیند. در همین راستا بهتازگی یک لاین ویرایش شده برنج مقاوم به بلاست که در آن ژنهای القا کننده مقاومت به این بیماری (C-ERF۹۲۲ و OsERF۹۲) توسط کریسپر مهندسیشده و درنتیجه موجب بهبود مقاومت به بیماری بلاست شده تولید گردیده است(Zhang et al. ۲۰۱۳; Li et al. ۲۰۱۶, Wang et al. ۲۰۱۶). همچنین دانشمندان یک نوع برنج مقاوم به علفکش را نیز توسط کریسپر تولید کردهاند (Sun et al. ۲۰۱۶).
از دیگر صفات کیفی که احتمال می رود در آینده ای نزدیک توسط دانشمندان با روش کریسپر در محصول برنج ایجاد شود، افزودن ویتامین A به این محصول پر مصرف است. یعنی تولید برنجی که دارای ژنهای لازم برای تولید ویتامین A در بخش خوراکی است؛ چیزی که بهطور طبیعی در گیاهان برنج رخ نمیدهد. این دغدغه از سال ها پیش در بین بیوتکنولوژیست های گیاهی وجود داشته است. چراکه سالانه حدود نیم میلیون کودک در کشورهای درحالتوسعه به دلیل کمبود ویتامین A نابینا میشوند. البته برنج غنی از ویتامین A با نام تجاری برنج طلایی یا Golden Rice (این نام به دلیل داشتن رنگ زرد آن در مقایسه با برنج سفید است) قبلا توسط تکنیک تراریخته تولید شده است؛ اما فعالان ضد محصولات تراریخته با تجاریسازی این محصول مبارزه کرده و مانع از تولید انبوه این برنج شدهاند. با استفاده از کریسپر بهاحتمال قوی دانشمندان تنها با تغییر ژنهایی که بهخودیِخود درون برنج فعال هستند، بدون افزودن ژن خارجی به همین نتیجه خواهند رسید که این امر میتواند حساسیتها و جنجالهای جنبشهای ضد محصولات تراریخته را نیز کاهش دهد.
اما دانشمندانی که روی کریسپر برنج کار میکنند در مرحله مهندسی ژنهای دخیل در صفات کیفی متوقف نشدهاند و به حوزه مهندسی ژنهای مسئول صفات کمّی نظیر عملکرد نیز ورود پیدا کردهاند. تولید بذور هیبرید یکی از مؤثرترین راههای افزایش عملکرد در برنج است. محققان اولین بار از روش Homology-Mediated End Joining ) HMEJ) به کاربرد کریسپر در برنج رسیدند. برای تولید بذور هیبرید برنج لاینهای عقیم حساس به دما و حساس به نور برای سرعت بخشیدن به خالصسازی و تولید هتروزیس ایجاد شدهاند (Yao et al. ۲۰۱۷; Zhang et al. ۲۰۱۳). طی سالهای اخیر، نوکلئاز SSN یا Sequence-Specific Nucleases یکی از قویترین ابزارها برای ویرایش هدفمند ژنها در گیاهان شناخته شده است و تکنیک کریسپر بهترین روش استفاده از این ابزار را در اختیار دانشمندان گذاشته است.
اخیراً تیمی از دانشگاه Purdueایالت متحده؛ به رهبری آقای Jian-Kang Zhu، با ویرایش همزمان ۱۳ ژن دخیل در عملکرد گیاه برنج، موفق به افزایش عملکرد این محصول تا ۳۱ درصد شدهاند که این دستاورد با تکنیکهای قبلی مهندسی ژنتیک تقریباً غیرممکن بود.
در مورد گندم چطور؟
«مجتبی پویان مهر»:برخلاف محصول برنج اما مهندسی ژنتیک و کریسپر در گندم دارای محدودیتهایی است. موفقیت جهشزایی در گندم در محدوده یک تا ۷.۵ درصد است و تا اواخر سال ۲۰۱۷ فقط ۱۰ مقاله در مورد ویرایش ژنی گندم در ژورنالهای معتبر بین المللی منتشر شده است. از جمله محدودیتهای مهندسی ژنتیک گندم نسبت به برنج، توانایی پایین باززایی این گیاه است. بهطوریکه در گندم نمیتوان گیاهان را از پروتوپلاست ویرایش ژنی شده باز زایی کرد. علاوه بر این، ژنوم گندم پیچیدگیهای زیادی دارد و کشت بافت این گیاه فرایند زمانبری است که میتواند دانشمندان را در هزارتوی ویرایش ژنومی این محصول قرار دهد.
بااینحال نخستین گندم ویرایش شده توسط کریسپر در سال ۲۰۱۴ توسط دانشمندان «آکادمی علوم چین» معرفی شده است. موفقیت ویرایش ژنومی گندم در این گزارش حدود ۵ درصد عنوان شد. البته همین گروه تحقیقاتی موفق شدند گندمهای غیر تراریختهای (Non-GMO) را توسط کریسپر تولید کنند. این تحقیق منجر به تولید گیاهان ویرایش شده غیر تراریخته در نسل اول (T۰) شد و برای این کار دانشمندان باید گیاهان باززایی شده بسیار زیادی را ژنوتایپینگ میکردند تا موتانتهای موردنظر را پیدا کنند.
این موضوع نیز در مورد محصول گندم باید اشاره شود که روشهای جهشزایی سنتی همچون روش TILLING )Targeting Induced Local Lesions in Genomes) هنوز بسیار جذاب بوده و محققان و اصلاح گران برای اصلاح گندم از آن استفاده میکنند. زیرا موقعیت تنظیمی به آنها اجازه میدهد تا گیاهان جهشیافته را کشت کرده و تجاریسازی کنند. اما به طور کلی باید گفت ازآنجاییکه گندم نسبت به جهشزایی بسیار مقاوم است ( دلیل این امر هگزاپلوئید بودن گندم است) و فراوانی ژنی زیادی در این گیاه مشاهده میشود، رغبت اصلاحگران برای استفاده از روشهای اصلاح کلاسیک و سنتی همچنان زیاد است (Global-engage.com).
با فراگیر شدن فناوری بهروزی مثل کریسپر در دنیا، بهتر نیست کشور ما هم که چند سالی است بر روی تولید و تجاریسازی محصولات حاصل از تکنیک تراریخته دچار سردرگمی است به سمت این فناوری حرکت کند؟
«مجتبی پویان مهر»:ببینید «ذات فناوری(تراریخته) اقتدارآفرین است» و ما باید به سمت بومیسازی تمام فناوریها، ازجمله فناوریهای نوین مهندسی ژنتیک که منافع عمدهای را به همراه خود برای کشور به ارمغان میآورند حرکت کنیم. صد البته این فناوریهای نوین بهخودیخود اصالت ندارند و شیوه کاربرد بشر از این فناوریها است که مشخص میکند این ابزار در خدمت انسانیت خواهد بود یا علیه آن! البته عمده مشکلات کشاورزی در کشور ما اقلیم خشک و شوری خاک است و چون این صفات جزو صفات چند ژنی هستند, تکنیک «کریسپر» میتواند با ویرایش این نوع ژن ها گیاهانی متحمل به خشکی و سایر تنش های غیرزیستی تولید کند.
«مجتبی پویان مهر»می گوید: بنده با ترسیم دوگانه هایی که مسئولین و متخصصین کشور را بین دو انتخاب مطلق قرار می دهند مخالف هستم. آیا اصلاح کلاسیک خوب است یا تراریخته؟! آیا تراریخته خوب است یا کریسپر؟!
وخودمهندس بیوتکنولوژیست(پویان مهر) به سوئال مطروحه اش اینگونه جواب می دهد:ایندست دوگانه ها، دوگانههای باطلی هستند که معمولاً ذهن را به سمت طرفداری از یک سمت و مخالفت با سمت دیگر ترغیب میکنند. همه فناوریها بهشرط اینکه بهجا و صحیح، مبتنی بر حل مسائل اصلی کشور و طبق الگوی نظاممند و کنترلشده استفاده شوند، خوب و در خدمت کشور خواهند بود.
بنابراین همانطور که پس از ظهور فناوریهای مهندسی ژنتیک شیوههای« اصلاح نباتات» کلاسیک همچنان کاربرد دارند و در دنیا منسوخ نشدهاند؛ به نظرم فناوریهای نسل اول مهندسی ژنتیک نیز میتوانند پس از فراگیری فناوریهای نسل سوم مهندسی ژنتیک -حتی نسلهای پیشرفتهتر که بشر بعدها به آنها دست خواهد یافت- کاربردهای صحیحی داشته باشند و گرهگشایی کنند.
البته کشورهای مبدع تکنیک کریسپر، تکنیکهای پیشین را کنار نگذاشته اند و همچنان گردش مالی قابلتوجهی در حوزه انواع محصولات حاصل از اصلاح کلاسیک و یا برخی محصولات تراریخته تائید شده دارند.
بنابراین به نظرم بهتر است بهجای مشغول کردن ذهن مردم و مسئولین در چارچوب دوگانههای کاذب، دانشمندان و مسئولین کشورمان را به سمت طراحی الگوهای صحیح و بومی بهرهبرداری از این فناوریهای نوظهور؛ بهگونهای که مخاطراتی برای کشور نداشته باشند و مسائل اصلی ما را حل کنند سوق دهیم./۱۹ آبان ۱۳۹۷خبرگزاری مهر.
توضیح مدیریت سایت-پیراسته فر:دراین مصاحبه ویرایش انجام داده ام+افزودن تصاویر،البته آقای مهندس پویان فردراین مصاحبه ها بیشترباواژه هابازی کرده تاتبیین واقعیتها،بعضاً هم دچارپارادوکس شده،که بایدآن راناشی ازعدم اشرافیت به این فنآوری پیچیده نوظهور ودرعین حال مهم دانست.
توضیح مدیریت سایت-پیراسته فر:برای اطلاع ازفنآوری«کریسپر»(CRISPR) به این لینک مراجعه کنید:
دستکاری درژنها DNAویرایش ژنها،تولدموجودات زنده وانسانها
خبرگزاری فارس (۳۰ آبان ۱۳۹۷)نوشت:فناوری نوین مهندسی ژنتیک به نام «کریسپر» و «تلنز» بزودی محصولات جدید غذایی را روانه بازار خواهد کرد درحقیقت این فناوری نوین مهندسی ژنتیک است که جایگزین محصولات تراریخته، GMO (محصولات دستکاری شده ژنتیکی) هستند اما این نگرانی وجود دارد که آیا مردم از این محصولات استفاده خواهند کرد یا نه.
در تولید محصولات تراریخته DNA یک ارگانیسم دیگر وارد DNA محصول میشود اما در اصلاح شده ژنتیکی gene-editingکه براساس بیوتکنولوژی کریسپر تولید میشوند مواد ژنتیکی آنها در حد ژنوم تغییر یا حذف میشود.
براساس این گزارش نخستین محصولات غذایی یا حیوانی که مواد ژنتیکی آنها اصلاح شده است از اوایل سال آینده به بازار خواهد رسید. مواد غذایی اصلاح شده ژنتیکی تکنولوژی متفاوتی از GMOهادارند.
آکادمی ملی علوم آمریکا میگوید: اصلاح ژنتیکی برای بهبود تولید مواد غذایی که بتواند جمعیت رو به رشد جهان را تغذیه کند ضروری است به هر صورت دولتها هنوز نمیدانند که چگونه از این ابزار اصلاح ژنتیکی که برای افزایش تولید استفاده میشود چشمپوشی کنند اما یک نگرانی هم وجود دارد که آیا مردم واقعا مواد اصلاح شده ژنتیکی را خریداری خواهند کرد یا نه.
«دان ویت هاس(دان وویتاس)»از موسسه «کالیکست» که سویای اصلاح شده ژنتیکی را برای افزایش کیفیت آن اصلاح کرده معتقد است، در صورتی که مصرف کنندگان از فواید این تکنولوژی بهرهمند شوند به استفاده از این محصول مشتاق خواهند شد و نگرانی آنها در زمینه این تکنولوژی کمتر خواهد شد. (دان وویتاس)
«دان وویتاس»(Dan VoytasL) ، استاد ژنتیک ، زیست شناسی سلولی و توسعه ، بنیانگذار این شرکت است و همچنان مسئول علمی اصلی آن است.
محققان از این تکنولوژی برای تولید چندین محصول با ویژگی جدید امتحان میکنند محصولاتی نظیر تولید گندم با فیبر بالا،قارچی که ماندگاری رنگش بیشتر باشد و تولید گوجه فرنگی با عملکرد بالا. آنها همچنین تلاش میکنند تا ذرتی را تولید کنند که به شرایط خشکی هوا مقام است و همچنین برنجی که در مقابل آلودگی مقاومت زیادی دارد.
برخی دانشمندان میگویند امیدوارند که استفاده از فناوری نوین مهندسی ژنتیک (کریسپر) به بیماری محصولات کشاورزی نظیر بیماری مرکبات پایان دهد. در این زمینه آنها باید ژنی را که باعث ایجاد مقاومت به بیماری در گیاه میشود را پیدا کنند.
فرد گمیتر در تحقیقات مرکبات دانشگاه فلوریدا گفت: اگر دانشمندان تغییرات اندکی در DNA گیاهان ایجاد کنند میتوانند با این بیماریها ایجاد کنند.
تفاوت محصولات تراریخته و اصلاح شده ژنتیکی
برای صدها سال کشاورزان به کمک تغییرات ژنتیکی تنوعی در محصولات و حیوانات خودشان ایجاد کردهاند که باعث بهتر شدن کیفیت و تولیدشان شده است.
اصلاح ژنتیکی به روش انتخابی که معمولا در طبیعت انجام میشود یا یک محقق پس از طی 13 زمان این اصلاح ژنتیکی را انجام میدهند میتواند کیفیت محصول آنها را افزایش دهد به عنوان مثال گونههای پیشرفته گوجهفرنگی بسیار بزرگتر از نوع وحشی است اما نوع جدید در برابر بیماریها آسیبپذیرتر است و البته از نظر ارزش غذایی هم با نوع وحشی تفاوت دارد.
GMO ها محصولات دستکاری شده ژنتیکی هستند که بخشی از DNA سایر حیوانات و ارگانیسمها به محصول اضافه میشوند و با آن ممزوج میشود تا اینکه یک ارگانیسم جدیدی با کیفیت ویژه ایجاد شود به طور مثال ذرت و سویای تراریخته حامل ژن باکتری است که به آن اضافه شده تا در برابر آفتهای حشره یا مواد شیمایی که برای گیاه کشنده است مقاوم باشد.
برخی میگویند که محصولات تراریخته مشکلی برای استفاده ندارد اما در دیگر سو بسیاری از مردم علاقهای به استفاده از آن ندارند. آنها نگران این هستند که محصولات تراریخته زمانی که در بدن استفاده میشود مشکلاتی را ایجاد کند و نتایج غیرقابل پیشبینی به بار بیاورد.
دو نوع فناوری نوین مهندسی ژنتیک به نام «کریسپر» و «تلنز» هم وجود دارد این فناوریهای نوین مانند قیچی عمل میکند و مولکولها را از DNA موجود زنده یا ارگانیسم قطع میکند. دانشمندان امیدوارند که این دو فناوری به آنها اجازه دهد تا تغییرات دقیقتری را در DNA گیاهان و حیوانات بدون اینکه نیازی به اضافه کردن DNA سایر میکروارگانیسمها آنگونه که در محصولات تراریخته انجام میشود، ایجاد کنند.
دانشمندان میگویند که این فرایند کم هزینه هم هست تاکنون محققان تمام تلاش خود را به کار گرفتهاند تا DNA موجود دیگر را به موجود جدید اضافه کنند که این نوع اصلاح ژنتیکی تراریخته نام دارد اما در این فناوری نوین نظیر کریسپر و تلنز بخشهایی در حد ژنوم حذف میشود.
مثلا سویای جدیدی که بدین روش تولید شده دو ژن آن حذف شده است. این ژنها باعث چاقی میشدند و میتوانست بیماریهای قبلی در انسان ایجاد کند. شرکت رکام باینتیک از طریق فناوری نوین مهندسی «کریسپر و تلنز» ژنی را که باعث رشد شاخ گاوهای هلشتاین میشد را برداشتهاند و بدین وسیله سلامتی گاوها بیشتر تامین شده است.
آیا روشهای جدید لازم است
وزارت کشاورزی آمریکا میگوید روشهای اضافی برای ضروری نیست که گیاهان بتوانند از طریق اصلاح ژنتیکی به روش قدیم رشد کنند. موسسه غذا و داور در سال ۲۰۱۷میلادی( ۱۳۹۶) قانون جدیدی را برای اصلاح ژنتیک حیوانات در نظر گرفت و قرار شد که نظرات خود را درباره این موضوع سال آینده ارائه دهد.
سازمان تجارت جهانی در ماه جاری ۱۲ کشور را نظیر استرالیا، کانادا، آرژانتین و برزیل را جمع کرد و آنها از دیگر کشورها خواستند تا قوانین نوین ژنتیکی که تقریبا جایگزین تراریخته است را بپذیرند.
شرکتهایی که در زمینه فناوریهای نوین مهندسی «کریسپر و تلنز» کار میکنند تلاش میکنند تا عواقب محصولات تراریخته در آنها ایجاد نشود. البته برخی مردم اینها را هم نمیپذیرند و اتحادیه اروپا قوانین محدودکنندهای درباره خرید و فروش اینها دارند.
«جنیفر کازما»که در مرکز اصلاح ژنتیک کارولینا کار میکند، گفت: بسیار مهم است که مطمئن شویم محصولاتی که از طریق اصلاح ژنتیک تولید میشوند سالم هستند با وجود این وی انتظار دارد که ۲۰ نوع محصول اصلاح شده ژنتیکی به روش نوین به بازارهای آمریکا طی ۵ سال آینده برسد، دانشمندان در حال مطالعه روی محصولات مهمی نظیرکاساوا در فقیرترین کشورها هستند.
توضیح مدیریت سایت-پیراسته فر:منبع این گزارش ،خبرگزاری فارس است واما من متوجه نشدم که پاسخگوی سئوالات مطروحه فارس چه شخصیتی بوده است؟
کریسپرچیست؟اتراریخته چیست؟کریسپر" تلنز"نوکلئاز