پیراسته فر
علمی،تحقیقی و تحلیلیپیراسته فر
علمی،تحقیقی و تحلیلیژنریک چیست؟تفاوتش بانام تجاری”برند"دارو
تفاوت نام ژنریک و نام تجاری داروها
داروی ژنریک (Generic Drug) یک نام عمومی دارد و ممکن است توسط هر تولیدهکنندهای، تولید و عرضه شود. اما داروهایی که نام تجاری دارند (Brand Name Drugs) مختص یک تولیدکنندهی خاص هستند.
«نام ژنریک »در واقع نشان دهنده مولکول شیمیایی داروهاست و در منابع علمی از آن استفاده می شود و امکان تغییر این نام وجود ندارد در حالیکه هر کارخانه داروسازی ممکن است برای یک دارو نام تجاری خاصی انتخاب کند.
به عنوان مثال داروی «آزیتروماسین »که یک داروی ژنریک است ممکن است صدها نام تجاری(برند)داشته باشد. در ایران پس از انقلاب اسلامی، از دهه ۱۳۶۰ به علت شرایط ویژه کشور کارخانجات داروسازی موظف به تولید دارو با استفاده از اسامی ژنریک شدند.تاقبل از آن «طرح ژنریک»اجراء نمی شد و ما در سال ۱۳۶۸ می خواستیم بر اساس الگوی مصرف سال ۱۳۵۶ عمل کنیم سالانه می بایست ۱۳ ملیلیارد دلار صرف واردات دارو کنیم در حالیکه در هیچ یک از سال های پس از انقلا ب بیش از نیم میلیارد دلار صرف واردات دارو نشد. البته در دهه ۸۰ دیگر طرح ژنریک جوابگوی نیاز کشور نبود و تغییراتی در قوانین کشور باعث ورود داروها برند با کیفیت بالا به بازار دارویی کشور شد.
کد آی( IRC) چیست؟
هیچ دارویی در کشور بدون داشتن کد آی آر سی اجازه تولید و فروش در بازار دارویی را ندارد. در واقع کد IRC مجوز تولید و ورود به بازر دارویی کشور است که توسط سازمان غذا و دارو صادر می شود و این شماره، برای هر دارو منحصر به فرد است.
مثلا کد IRC«قرص استامینوفن ۳۲۵ میلی گرم »از یک کارخانه با «کد IRC قرص استامینوفن ۵۰۰ میلی گرم» از همان کارخانه متفاوت است.
داروهای ژنریک(GENERIC DRUGS)
داروی ژنریک (Generic Drug) داروی عمومی که ممکن است توسط هر تولیدهکنندهای، تولید و عرضه شود. اما داروهایی که نام تجاری دارند (Brand Name Drugs) مختص یک تولیدکنندهی خاص هستند.
شرکت های داروسازی میلیاردها دلار در طول چندین سال سرمایه گذاری می کنند تا خط لوله دارویی محصولات (محصولات) خود را تأیید ، ثبت و از حق ثبت اختراع محافظت کنند تا سود حاصل از چنین مالکیت نام تجاری را در یک بازار جهانی کاملاً رقابتی به حداکثر برسانند. با این حال ، انقضا (the )حق ثبت اختراع مارک (های) تجارتی آنها به دلیل رقابت داروهای جدید عمومی که وارد بازار می شود ، می تواند به سرعت جریان درآمد یک شرکت دارویی را تحت تأثیر قرار دهد.
داروهای ژنریک ، دارای حق انحصاری (patent) هستند؛ در اغلب موارد حقوق انحصاری این داروهای جدید برای ۲۰ سال حفظ میشود. در طی این مدت هیچکس دیگری نمیتواند داروی دارای حق انحصاری را بسازد یا بفروشد.
داروهای ژنریک تا ۹۰ درصد از داروهای مشابه با نام تجارتی ارزانتر هستند.
هنگامی که یک داروی جدید در جهان ساخته می شود، دارای حق انحصاری (patent) است که عموما این حق برای چندین سال حفظ می شود. به این دارو که برای نخستین بار مجوز توزیع در بازارهای جهانی را دریافت کرده، «داروی برند اصلی» گفته می شود. وقتی دوره حق انحصاری داروهای برند اصلی به اتمام می رسد، سایر شرکت های دارویی پس از اخذ مجوزهای لازم می توانند ساخت دارویی مشابه و یکسان با داروی برند اصلی را آغاز کنند. این دارو باید از لحاظ ماده موثره، اثربخشی، ایمنی و طریقه مصرف با داروی برند اصلی یکسان یا برتر از آن باشد و قابلیت جایگزینی با آن را داشته باشد. به دارویی که از نظر موارد گفته شده با داروی برند اصلی یکسان است، داروی ژنریک گفته می شود. طبیعی است که سازندگان داروهای ژنریک باید داروی خود را با قیمتی پایین تر از داروی برند اصلی به فروش برسانند چراکه این شرکت ها هزینه ای بابت پژوهش و یافتن فرمولاسیون دارو متحمل نشده اند.
هنگامی که دوره حق انحصاری دارویی به اتمام میرسد، سایر شرکتها میتوانند پس از تصویب FDA شروع به ساختن شکل ژنریک این دارو کنند. سازندگان داروهای ژنریک میتوانند این داروها را با قیمت کمتری بفروشند، زیرا متحمل هزینههای بالای پژوهش و ساخت دارو در ابتدا را نشدهاند.
هنگامی که دوره حق انحصاری دارویی به اتمام میرسد، سایر شرکتها میتوانند پس از تصویب FDA شروع به ساختن و فشار شکل ژنریک این دارو کنند. سازندگان داروهای ژنریک میتوانند این داروها را با قیمت کمتری بفروشند، زیرا متحمل هزینههای بالای پژوهش و ساخت دارو در ابتدا را نشدهاند.
سازمان غذا و داروی آمریکا بر ساخت داروهای ژنریک نظارت دارد و اجازه نمیدهد که این داروها در کارخانههای زیراستاندارد ساخته شوند.
سازمان غذا و داروی آمریکا(FDA) می گوید ،تعدادی از داروهای نسخهای هستند که "پنجره درمانی باریکی" دارند. در این گروه داروها، مقدار اندک دارو از نوع ژنریک موثر نیست، و مقدار بیش از حد آن مسمومیت ایجاد میکند. بنابراین جایگزین کردن اشکال ژنریک در این گروه داروها میتواند مشکل سازباشد.
FDA برای ارزیابی داروهای ژنریک از رویکرد «معادل زیستی»(bioequivalent) استفاده میکند. اساس مفهوم معادل زیستی، نبودن تفاوت قابلتوجه در میان داروها، یا با بیان کمی، تفاوت کمتر از ۲۰ از درصد است.
«داروسازان ژنریک» ملزم هستند که آزمایشهایی را انجام دهند که ثابت کند «میزان ماده موثر جذبشده به جریان خون از نسخههای داروی ساخته شده بوسیله آنها، معادل میزان جذبشده داروهای اصلی با نام تجارتی است».
FDA میگوید: میانگین واریانس میان داروهای با نام تجارتی و داروهای ژنریک ۳.۵ درصد است، اما در ۵۰ درصد این داروها این تفاوت ۱۰ درصد یا بیشتر است.
پنجره درمانی(THERAPEUTI WINDOW)
پنجره درمانی که معیار کاربردی تری برای ایمنی یک دارو است به دامنه دوز بین حداقل غلظت یا دوزدرمانی و حداقل غلظت یا دوزسمی گفته می شود.
مثال: اگر حداقل غلظت پلاسمایی درمانی تئوفیلین ۸ میلی گرم در لیتر باشد واثرات سمی در غلظت بالاتر از ۱۸ میلی گرم در لیتر مشاهده شود پنجره درمانی ۱۸-۸ میلی گرم در لیتر می باشد.
ازجمله از داروهای با «پنجره درمانی باریک» عبارتنداز:
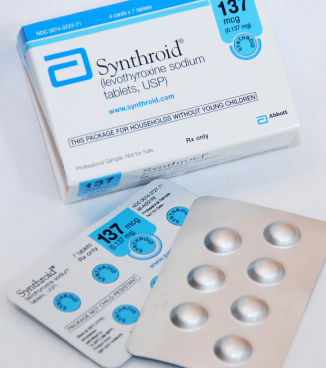
* داروهای تیروئیدی: لووتروئید، لووکسیل یا سینتروئید (نام ژنریک: لووتیروکسین).
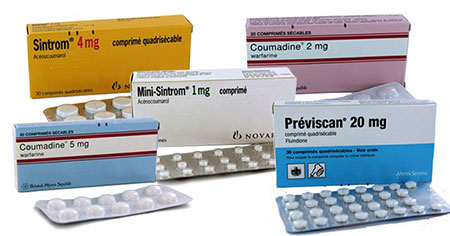
* داروهای رقیقکنندههای خون: کومادین (ژنریک: وارفارین)
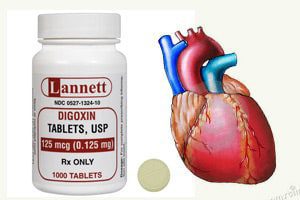
* داروهای قلبی: دیجیتک، لانوکسین ( ژنریک: دیگوکسین).
* داروهای روانپزشکی: اسکالیت، لیتوبید (ژنریک: لیتیوم).
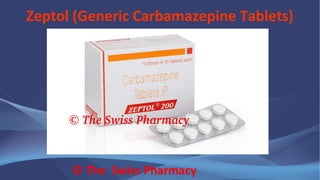
* داروهای ضدتشنج: دیلوتین ( ژنریک: فنیتوئین)، تگرتول (ژنریک: کارمابازپین).
حق انحصاری (patent)داروچیست؟
داروی ژنریک (Generic Drug)داروی عمومی
تفاوت داروی"تجاری"ژنریک
سازمان غذا و داروی آمریکا(FDA) چیست؟





